题目内容
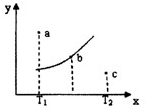
反应aX(g)+bY(g)?cZ(g);△H=Q,有如图所示关系,下列判断中正确是( )
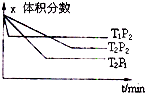
| A.a+b<c,Q>0 | B.a+b<c,Q<0 | C.a+b>c,Q>0 | D.a+b>c,Q<0 |

由图可知,温度都为T2时,压强P1先到达平衡,则压强P1>P2,压强越大,平衡时X的体积分数越小,说明增大压强平衡向正反应方向移动,则正反应是气体体积减小的反应,即a+b>c,
压强都为P2时,温度T1先到达平衡,故温度T1>T2,温度越高,平衡时X的体积分数越大,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,即Q<0,
故选D.
压强都为P2时,温度T1先到达平衡,故温度T1>T2,温度越高,平衡时X的体积分数越大,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,即Q<0,
故选D.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目