题目内容
目前工业上有一种方法是用CO2来生产燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,为探究反应原理,现进行如下实验:
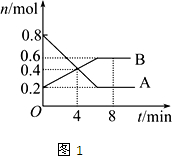
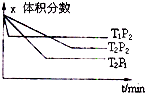
在体积为1L的密闭容器中,充入1molCO2和4molH2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min).
(2)该反应的平衡常数表达式为______.
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1molCO2和4molH2
(4)如果在相同的容器中事先充入1molCH3OH和1molH2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为______.

在体积为1L的密闭容器中,充入1molCO2和4molH2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min).
(2)该反应的平衡常数表达式为______.
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1molCO2和4molH2
(4)如果在相同的容器中事先充入1molCH3OH和1molH2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为______.

(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
=0.225mol/(L?mon),
故答案为:0.225;
(2)反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数k=
,
故答案为:
;
(3)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B、充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D、再充入1molCO2和4molH2,相当于充入1molCO2和3molH2,达平衡后再通入1molH2.等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,再通入1molH2,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
(4)在相同的容器中事先充入1molCH3OH和1molH2O,按化学计量数转化到左边得到n(CO2)=1mol,n(H2)=3mol,使反应达到的化学平衡与原平衡相同,故起始还需加入H2的物质的量为4mol-3mol=1mol,
故答案为:1mol.
| 2.25mol/L |
| 10min |
故答案为:0.225;
(2)反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数k=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
故答案为:
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(3)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B、充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D、再充入1molCO2和4molH2,相当于充入1molCO2和3molH2,达平衡后再通入1molH2.等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,再通入1molH2,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
(4)在相同的容器中事先充入1molCH3OH和1molH2O,按化学计量数转化到左边得到n(CO2)=1mol,n(H2)=3mol,使反应达到的化学平衡与原平衡相同,故起始还需加入H2的物质的量为4mol-3mol=1mol,
故答案为:1mol.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目