题目内容
(13分)海藻中提取碘的流程如图:
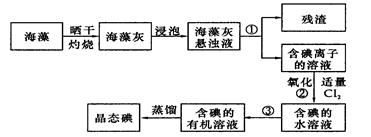
(1)指出提取碘的过程中有关实验操作名称:①__________,③________;写出过程②中有关反应的离子方程式_____________________________
(2)在提取碘的过程中,可供选择的有机试剂有下列四组,均可使用的是______ 。
(3)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
(注:下图片中深色区为紫红色溶液)

(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器、物品,尚缺少的玻璃仪器是_____________。
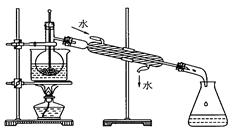
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图实验装置中的错误之处。
①____________ ;②_____________;③____________________。

(1)指出提取碘的过程中有关实验操作名称:①__________,③________;写出过程②中有关反应的离子方程式_____________________________
(2)在提取碘的过程中,可供选择的有机试剂有下列四组,均可使用的是______ 。
| A.苯、酒精 | B.四氯化碳、苯 | C.汽油、醋酸 | D.汽油、氨水 |
(注:下图片中深色区为紫红色溶液)


(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器、物品,尚缺少的玻璃仪器是_____________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图实验装置中的错误之处。
①____________ ;②_____________;③____________________。
(10分)(1) ①过滤,③萃取分液;Cl2+ 2I- ="=" 2Cl-+ I2
(2)B。 (3) ( D ) (4)普通漏斗 分液漏斗 (各1分,共2分)
(5) ①温度计不能插入溶液中,应放在支管口;
②冷凝管中水流方向相反了; ③没有石棉网
(2)B。 (3) ( D ) (4)普通漏斗 分液漏斗 (各1分,共2分)
(5) ①温度计不能插入溶液中,应放在支管口;
②冷凝管中水流方向相反了; ③没有石棉网
略

练习册系列答案
相关题目


 (写出一个即可)。
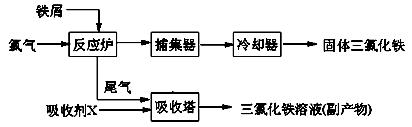
(写出一个即可)。 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: