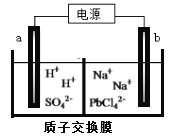
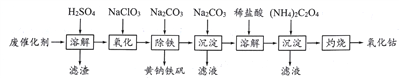
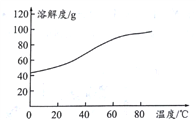
��Ŀ����
����Ŀ��A��B��C��D��E��F��ʾ����10�����ӵ�������ش�
��1��A����Ϊ����������Aԭ��������������ԭ�Ӱ뾶�����A������______���������ӷ��ţ�
��2��D��������Ԫ����ɵķ��ӣ���ˮ��Һ�ʼ��ԣ�D�Ľṹʽ��_______________��
��3����B����Һ�м��뺬F����Һ���ȳ��ְ�ɫ�������������뺬F����Һ�����ܽ⣬д���ù��̵����ӷ���ʽ__________________________________
��4����E����Һ�м��뺬F����Һ������������ C��D��д�������ӷ���ʽ____________________��
���𰸡� Na+ ![]() Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O NH4++OH-=NH3��+H2O
Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O NH4++OH-=NH3��+H2O
������������������10�����ӵ����У�Ne��CH4��NH3��H2O��HF��NH4+��OH-��H3O+��O2-��F-��Na+��Mg2+��Al3+�ȣ����ݸ����ӵ���ɺ����ʽ����⡣
��⣺����10�����ӵ����У�Ne��CH4��NH3��H2O��HF��NH4+��OH-��H3O+��O2-��F-��Na+��Mg2+��Al3+�ȣ���
��1��A����Ϊ����������Aԭ��������������ԭ�Ӱ뾶�����AΪNaԪ�أ�A������Na+��
��2��������Ԫ����ɵķ��ӣ���ˮ��Һ�ʼ��Ե�������NH3���ṹʽΪ![]() ��
��
��3����B����Һ�м��뺬F����Һ���ȳ��ְ�ɫ�������������뺬F����Һ�����ܽ⣬��BΪAl3+��FΪOH-����Ӧ�����ӷ���ʽ�ֱ�Ϊ��Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O��
��4�������Ϸ�����֪EΪNH4+��FΪOH-��CΪNH3��DΪH2O����Ӧ�����ӷ���ʽΪNH4++OH-=NH3��+H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�