题目内容
下列与化学概念有关的说法正确的是
| A.电解、电离的过程都需要消耗电能 |
| B.元素的非金属性越强,对应单质的活泼性一定越强 |
| C.有单质参加或生成的化学反应一定是氧化还原反应 |
| D.只含共价键的物质不一定是共价化合物 |
D
解析试题分析:A、电离为电解质在水溶液或熔融状态下离解为自由移动离子的过程,不需要消耗电能,错误;B、单质的活泼性还与构成单质的原子间化学键强弱有关,如N非金属性较强,但由于N≡N键能较大,故N2性质较稳定,故B错误;C、同素异形体间的转化为非氧化还原反应,如3O2=2O3,故C错误;D、有些离子化合物中可能也含有共价键,如NaOH中有共价键,为离子化合物,D正确。
考点:考查化学基本概念。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
不能用离子方程式CO32-+2H+ CO2↑+H2O表示的是
CO2↑+H2O表示的是
A.Na2CO3+2HCl 2NaCl +CO2↑+H2O 2NaCl +CO2↑+H2O | B.NaHCO3+HCl NaCl +CO2↑+H2O NaCl +CO2↑+H2O |
C.K2CO3+H2SO4 K2SO4 +CO2↑+H2O K2SO4 +CO2↑+H2O | D.K2CO3+2HNO3 2KNO3 +CO2↑+H2O 2KNO3 +CO2↑+H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:H+、Fe2+、SO42-、NO3- |
| B.使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- |
| C.0.1 mol·L-1的BaCl2溶液中:K+、Na+、OH-、NO3ˉ |
| D.由水电离出的c(H+)=10-12 mol·L-1的溶液中:Mg2+、K+、Br-、HCO3- |
下列离子方程式正确的是
| A.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+=H2O+CO2↑ |
| B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
| C.硫酸铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ |
| D.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ |
下列表示对应化学反应的离子方程式正确的是
| A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑ |
| B.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O |
| C.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| D.向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O |
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、NO2—、AlO2—、CO32-、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是 ( )
| A.气体甲可能为CO2或者SO2 |
| B.沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42—、NO2— |
| D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |
根据下图的转化关系判断下列说法正确的是(反应条件已略去)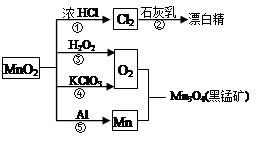
| A.反应①②③④⑤均属于氧化反应和离子反应 |
| B.反应⑤说明该条件下铝的还原性强于锰 |
| C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D.反应①中氧化剂与还原剂的物质的量之比为1:4 |
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是 ( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO 、K+ 、K+ | 稀硫酸 | 3Fe2++NO +4H+=3Fe3++NO↑+2H2O +4H+=3Fe3++NO↑+2H2O |
| B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
| C | Ba2+、HCO 、Cl- 、Cl- | 氢氧化钠溶液 | HCO + OH-=CO + OH-=CO +H2O +H2O |
| D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
下列离子方程式正确的是
| A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4 |
B.亚硫酸氢钠溶液呈酸性:HSO +H2O +H2O H3O++SO H3O++SO |
| C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO =Ag++NO↑+H2O =Ag++NO↑+H2O |