题目内容
在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是( )


| A.a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B.b→c时发生的离子反应为:H+ + OH— → H2O |
| C.c→d时离子的物质的量:Ba2+可能大于Cl— |
| D.d→e时离子的物质的量:Ba2+一定大于OH— |
B
试题分析:往混合溶液中加Ba(OH)2溶液,开始阶段发生的反应为Ba2++SO42- +2H+ + 2OH— = BaSO4↓+ 2H2O,图像为a-b段;当SO42- 被完全沉淀时,还有2mol H+ ,所以继续滴加Ba(OH)2溶液,发生的反应为H+ + OH— = H2O,无沉淀产生,图像为b-c段,该阶段消耗Ba(OH)2 1mol;再继续滴加Ba(OH)2溶液,发生反应为Mg2++ 2OH— = Mg(OH)2↓,所以沉淀有增多,图像为c-d段,当镁离子完全被沉淀,则沉淀不再增多,图像保持d-e段趋势。所以正确的是B,选B。

练习册系列答案
相关题目
 >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2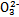
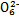 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1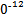 )。
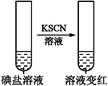
)。
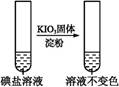
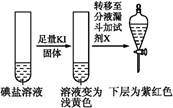


 反应
反应