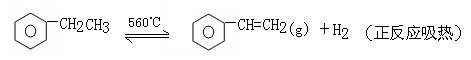
题目内容
(08深圳宝安区一模)将氨水滴加到盛有AgC1的试管中,AgC1逐渐溶解,对上述过程,下列叙述或解释中正确的有()
A.所得溶液中c(Ag+)×c(C1-)<KSP(AgC1)
B.所得溶液中形成了难电离的物质
C.上述实验说明C1―与NH4+间有很强的结合力
D.上述过程中NH3?H2O的电离程度增大

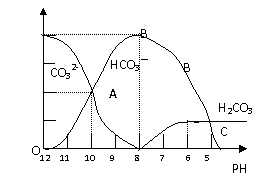
(08深圳宝安区一模)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示:
 |
回答下列问题:
(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是(用离子方程式表示): ;其溶液中所有阳离子和阴离子的浓度有何关系?(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则KSP(X)= 。
(4)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(5)请写出OAB段的离子方程式 ;当混合液的PH= 时,开始放出CO2气体。