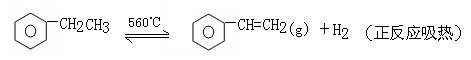
题目内容
(08深圳宝安区一模)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示:
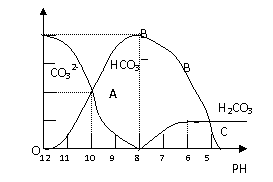 |
回答下列问题:
(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是(用离子方程式表示): ;其溶液中所有阳离子和阴离子的浓度有何关系?(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则KSP(X)= 。
(4)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(5)请写出OAB段的离子方程式 ;当混合液的PH= 时,开始放出CO2气体。
答案:
(1)CO2-3 +H2O-3+OH- (1分);C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)(1分)
(2) 用pH试纸(或pH计)测常温下0.1mol?L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。(2分)
(3)8.0×10-9(2分)
(4)CO32-和HCO3-(1分) 11(1分) (5) CO32-+H+=HCO3- (1分);6 (2分)