题目内容
B、C、D、E均是短周期元素。B元素原子最外层上的电子数为内层电子总数的2倍。B元素原子和C元素原子最外层电子数之差为2。C和D形成的化合物进行焰色反应火焰呈黄色。E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应。
(1)上述4种元素按照原子序数由大到小排列为____、____、____、____;(填元素符号);
(2) B、C形成的化合物(比空气重)的结构式为 ;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为_____;X的电子式为 ;
(4)Y是C的气态氢化物。常温下,将D的单质投入Y中,发生反应的离子方程式为__________________;该反应__________(填“能”、“不能”)作为设计原电池的反应原理。
(1)Cl、Na、O、C
(2) 
(3) 离子键、(非极性)共价键 
(4) 2Na+2H2O
 2 Na++2 OH-+H2↑ 能
2 Na++2 OH-+H2↑ 能
【解析】
试题分析:由题可以推断出B、C、D、E分别为C、O、Na、Cl,所以(1)上述4种元素按照原子序数由大到小排列为Cl、Na、O、C;(2) B、C形成的化合物为CO2,其结构式为 ,(3)C、D的单质在加热条件下生成物质X为Na2O2,其含有化学键的类型为离子键、(非极性)共价键,其电子式为
,(3)C、D的单质在加热条件下生成物质X为Na2O2,其含有化学键的类型为离子键、(非极性)共价键,其电子式为 ;(4)Y为H2O,D为Na,所以将D的单质投入Y中,发生反应的离子方程式为
;(4)Y为H2O,D为Na,所以将D的单质投入Y中,发生反应的离子方程式为
2Na+2H2O  2 Na++2 OH-+H2↑;因为该反应为氧化还原反应,所以该反应能作为设计原电池的反应原理。
2 Na++2 OH-+H2↑;因为该反应为氧化还原反应,所以该反应能作为设计原电池的反应原理。
考点:元素及其化合物
点评:本题考查了元素及其化合物的知识,其出题的模式为高考出题模式的热点,该提综合性高,有一定的难度。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案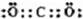
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是