��Ŀ����
����Ŀ�������������в���ȱ�ٵ�Ԫ��֮һ�������γɶ��ֻ���� 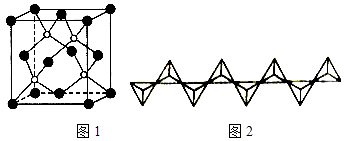
��1����̬��ԭ���У�����ռ�ݵ�����ܲ����Ϊ�����ܲ��е���ռ�ݵ�������ߵĵ������ڿռ�������չ����ԭ�ӹ�����Σ�
��2����Ԫ����ͬ����������Ԫ����ȣ���һ�������ɴ�С��˳��Ϊ ��
��3����������Cl2��Ӧ����������PCl3��PCl5 �� ���и�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ������У�Pԭ�ӵ��ӻ��������Ϊ �� ����ӵĿռ乹��Ϊ ��
��4������BP����һ�ֳ�Ӳ��ĥͿ����ϣ���ͼ1Ϊ�侧������ԭ������ԭ������ľ���Ϊacm����Mg/mol��ʾ�����Ħ��������NA��ʾ�����ӵ�������ֵ������������ܶ�Ϊ ��
��5��H3PO4Ϊ��Ԫ��ǿ�ᣬ��Fe3+�γ�H3[Fe��PO4��2]�������ʳ������ڱ���Һ�е�Fe3+ �� ��̬Fe3+�ĺ�������Ų�ʽΪ��PO43����ΪΪFe�ṩ ��
��6�������η�Ϊֱ���������Ρ�֧��״�������κͻ�״��ƫ���������࣮ijֱ���������Ƶ������ӳ���ͼ2��ʾ��������״�ṹ����������������ͨ�����ö�����ԭ����������ö������ƵĻ�ѧʽΪ ��
���𰸡�
��1��M��3������
��2��P��S��Si
��3��sp3��������
��4��![]()
��5��1s22s22p63s23p63d5��PO43�����¶Ե���
��6��NaPO3
���������⣺��1��Pԭ�Ӻ�����15�����ӣ��������Ų������������ܲ㣬���Ե���ռ�ݵ�����ܲ����ΪM�������Ϊ3s2p3 �� p����ĵ���������ά�ռ�������x��y��z��3���������죬pԭ�ӹ��Ϊ�����Σ� ���Դ��ǣ�M��3�����壻��2��C��N��OԪ����ͬһ��������Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ���PԪ��ԭ��3p�ܼ��ǰ����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������P��S��Si��
���Դ��ǣ�P��S��Si����3����������Cl2��Ӧ����������PCl3��PCl5 �� PCl3��P��Cl������8�����ȶ��ṹ��PCl3��Pԭ�ӵļ۲���Ӷ���Ϊ3+ ![]() ��5��1��3��=4��Pԭ�ӵ��ӻ��������Ϊsp3 �� ���Է��ӵĿռ乹��Ϊ�����ͣ�
��5��1��3��=4��Pԭ�ӵ��ӻ��������Ϊsp3 �� ���Է��ӵĿռ乹��Ϊ�����ͣ�
���Դ��ǣ�sp3�������ͣ���4��AB��AC��AD��BC��BD��CD�ı߳���ȣ�AF��BF�ij����Ϊa��Fλ�������ϣ�Oλ����������BCD�������ϣ�����������BCD�У�BEΪ������BCD�ĸߣ���CEΪBC��һ�룬��ͼ  ��
��
����������ı߳�Ϊx��CE�ij�Ϊ0.5x��BE= ![]() =
= ![]() x��BO��OE�ij�֮��Ϊ2��1����BO�ij�Ϊ=
x��BO��OE�ij�֮��Ϊ2��1����BO�ij�Ϊ= ![]() ��
�� ![]() =
= ![]() x����������ABO��AO�ij�=
x����������ABO��AO�ij�= ![]() =
= ![]() ����������BFO��OF�ij�=
����������BFO��OF�ij�= ![]() ��a=
��a= ![]() ��x=
��x= ![]()
![]() ������������ı߳�Ϊx���Խ��߳�2x���������ⳤΪ2x��
������������ı߳�Ϊx���Խ��߳�2x���������ⳤΪ2x�� ![]() =
= ![]() x=
x= ![]()
![]() ��
��
һ�������к���Pԭ�ӣ�8�� ![]() +6��
+6�� ![]() =4����Bԭ�����ڲ�����4������һ�������к���4��BP���ܶȵı���ʽ��=
=4����Bԭ�����ڲ�����4������һ�������к���4��BP���ܶȵı���ʽ��= ![]() =
= ![]() =
= ![]() ��
��
���Դ��ǣ� ![]() ����5������26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ����ݹ���ԭ�����������Ų�ʽΪ1s22s22p63s23p63d64s2 �� ���̬Fe3+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d5��H3[Fe��PO4��3]��PO43��Ϊ���壬Fe3+Ϊ�������ӣ����������ṩ�չ���������ṩ�¶Ե��ӣ�
����5������26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ����ݹ���ԭ�����������Ų�ʽΪ1s22s22p63s23p63d64s2 �� ���̬Fe3+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d5��H3[Fe��PO4��3]��PO43��Ϊ���壬Fe3+Ϊ�������ӣ����������ṩ�չ���������ṩ�¶Ե��ӣ�
���Դ��ǣ�1s22s22p63s23p63d5��PO43�����¶Ե��ӣ���6������״�ṹ��֪ÿ��P��3��O�γ������ӣ���P�Ļ��ϼ�Ϊ+5�ۣ����γɵĻ����ﻯѧʽΪNaPO3 �� ���Դ��ǣ�NaPO3 ��