题目内容
6.现有下列A、B两组物质:A组:CH3-CHCl-CH3、
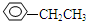 、HCOOH、CH3COOC2H5.
、HCOOH、CH3COOC2H5.B组:CH3CH2CH2OH、银氨溶液、KOH溶液、Na2CO3溶液.
试回答:
(1)A组中HCOOH能跟B组中所有物质都可发生反应.
(2)B组中NaOH溶液可跟A组中的三种物质反应.
分析 (1)HCOOH分别与B中物质发生酯化反应、银镜反应、中和反应、复分解反应;
(2)B组中只有NaOH分别与A组物质CH3-CHCl-CH3、HCOOH、CH3COOC2H5发生水解反应、中和反应、水解反应,与乙苯不反应.
解答 解:(1)A组中只有HCOOH分别与B中物质发生酯化反应、银镜反应、中和反应、复分解反应,故答案为:HCOOH;
(2)B组中只有NaOH分别与A组物质CH3-CHCl-CH3、HCOOH、CH3COOC2H5发生水解反应、中和反应、水解反应,故答案为:NaOH溶液.
点评 本题考查有机物的结构与性质,侧重有机物性质的考查,为高频考点,注意把握有机物的结构和官能团的性质,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
17.下列有关化学用语表示正确的是( )
①CSO的电子式: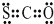
②对硝基苯酚的结构简式: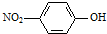
③Cl-的结构示意图: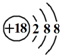
④甲烷分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+.
①CSO的电子式:
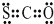
②对硝基苯酚的结构简式:
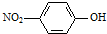
③Cl-的结构示意图:

④甲烷分子的比例模型:

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+.
| A. | ③⑤⑥⑦ | B. | ②③④⑥ | C. | ①④⑤ | D. | 全部正确 |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下11.2LO2和16gO3中含有的O数均为 NA | |
| B. | 32g氧气所含质子数为NA | |
| C. | 1mol/L的CaCl2溶液中含有的Cl-为2NA | |
| D. | 12.6g水所含电子数目为0.7NA |
11.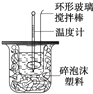 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mo(l):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ•mol-1 ( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)a、b、c.
a.实验装置保温、隔热效果差b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mo(l):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均 值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)a、b、c.
a.实验装置保温、隔热效果差b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
18.下列说法正确的是( )
| A. | 在化学反应中,化学能只可以转化为热能 | |
| B. | 合成氨反应N2+3H2?2NH3,当N2、H2、NH3浓度相等时该反应达到了最大限度 | |
| C. | 合成氨反应N2+3H2?2NH3中,升高温度,该反应速率减小 | |
| D. | 化学键的断裂和形成是化学反应中能量变化的主要原因 |
15.下列反应的离子方程式书写正确的是( )
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 以石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | FeSO4溶液与稀H2SO4溶液、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
 如图是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在广口瓶中加入液体或在干燥管中放入固体).
如图是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在广口瓶中加入液体或在干燥管中放入固体).