题目内容
根据要求,做以下有关离子反应的题目(一)从①Ba(OH)2 ②H2SO4 ③Zn ④CuSO4
⑤CaCO3 ⑥HNO3 ⑦NaOH中选出合适的物质,实现下列各题要求的反应.
ⅰ.选出合适的物质并写出化学反应的离子方程式.
(1)实验室制取CO2的反应:______,______.
(2)实验室制取H2的反应:______,______.
ⅱ.选出合适的物质并写出与下列离子方程式相对应的化学方程式.
(3)Cu2++2OH-═Cu(OH)2↓______,______;
(4)H++OH-═H2O______,______;
(二)有A、B、C三种无色溶液,只知道是HCl、H2SO4、Ba(NO3)2三种物质的溶液中的各一种,按一定顺序滴入Na2CO3溶液中,至恰好完全反应,有以下现象:
①加入A时,生成白色沉淀;②向①中沉淀加入B时,沉淀溶解,并有气体放出;③向②中生成的溶液中加入C时,又有白色沉淀生成.
判断A、B、C溶液中溶质分别为:A______,B:______,C:______.
【答案】分析:(一)ⅰ.(1)实验室利用盐酸和碳酸钙制取二氧化碳;
(2)实验室利用Zn与稀硫酸反应制取氢气;
ⅱ.(3)可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐可用Cu2++2OH-═Cu(OH)2↓表示;
(4)强碱与强酸反应生成可溶性盐和水的离子反应为H++OH-═H2O;
(二)①加入A时,生成白色沉淀,则A为Ba(NO3)2,向①中沉淀加入B时,沉淀溶解,并有气体放出;③向②中生成的溶液中加入C时,又有白色沉淀生成,则B为HCl,C为H2SO4,以此来解答.
解答:解:(一)ⅰ.(1)实验室利用盐酸和碳酸钙制取二氧化碳,选择试剂为⑤⑥,离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:⑤⑥;CaCO3+2H+═Ca2++CO2↑+H2O;
(2)实验室利用Zn与稀硫酸反应制取氢气,选择试剂为②③,离子反应为Zn+2H+═H2↑+Zn2+,
故答案为:②③;Zn+2H+═H2↑+Zn2+;
ⅱ.(3)可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐可用Cu2++2OH-═Cu(OH)2↓表示,则选择④⑦,化学反应为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,
故答案为:④⑦;CuSO4+2NaOH═Cu(OH)2↓+Na2SO4;
(4)强碱与强酸反应生成可溶性盐和水的离子反应为H++OH-═H2O,试剂为⑥⑦或②⑦或①⑥,化学反应为HNO3+NaOH═NaNO3+H2O或H2SO4+2NaOH═2H2O+Na2SO4或Ba(OH)2+2HNO3═2H2O+Ba(NO3)2,
故答案为:⑥⑦;HNO3+NaOH═NaNO3+H2O;
(二))①加入A时,生成白色沉淀为碳酸钡,则A为Ba(NO3)2,向①中沉淀加入B时,沉淀溶解,并有气体放出,气体为二氧化碳;③向②中生成的溶液中加入C时,又有白色沉淀生成,该白色沉淀为硫酸钡,则B为HCl,C为H2SO4,故答案为:Ba(NO3)2;HCl;H2SO4.
点评:本题考查离子反应及气体的制取,注意(一)实验室常用大理石(CaCO3)与稀盐酸或稀硝酸反应制取CO2;常用Zn与稀硫酸或稀盐酸反应制取氢气;
(二)向Na2CO3溶液中加入A,生成白色沉淀,则A为Ba(NO3)2,发生反应:Na2CO3+Ba(NO3)2═BaCO3↓+2NaNO3;加入B时,沉淀溶解,则B为HCl,发生反应:BaCO3+2HCl═BaCl2+H2O+CO2↑,则C为剩余的H2SO4.明确这两点即可解答,题目难度不大,注重基础知识的考查.
(2)实验室利用Zn与稀硫酸反应制取氢气;
ⅱ.(3)可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐可用Cu2++2OH-═Cu(OH)2↓表示;
(4)强碱与强酸反应生成可溶性盐和水的离子反应为H++OH-═H2O;
(二)①加入A时,生成白色沉淀,则A为Ba(NO3)2,向①中沉淀加入B时,沉淀溶解,并有气体放出;③向②中生成的溶液中加入C时,又有白色沉淀生成,则B为HCl,C为H2SO4,以此来解答.
解答:解:(一)ⅰ.(1)实验室利用盐酸和碳酸钙制取二氧化碳,选择试剂为⑤⑥,离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:⑤⑥;CaCO3+2H+═Ca2++CO2↑+H2O;
(2)实验室利用Zn与稀硫酸反应制取氢气,选择试剂为②③,离子反应为Zn+2H+═H2↑+Zn2+,
故答案为:②③;Zn+2H+═H2↑+Zn2+;
ⅱ.(3)可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐可用Cu2++2OH-═Cu(OH)2↓表示,则选择④⑦,化学反应为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,
故答案为:④⑦;CuSO4+2NaOH═Cu(OH)2↓+Na2SO4;
(4)强碱与强酸反应生成可溶性盐和水的离子反应为H++OH-═H2O,试剂为⑥⑦或②⑦或①⑥,化学反应为HNO3+NaOH═NaNO3+H2O或H2SO4+2NaOH═2H2O+Na2SO4或Ba(OH)2+2HNO3═2H2O+Ba(NO3)2,
故答案为:⑥⑦;HNO3+NaOH═NaNO3+H2O;
(二))①加入A时,生成白色沉淀为碳酸钡,则A为Ba(NO3)2,向①中沉淀加入B时,沉淀溶解,并有气体放出,气体为二氧化碳;③向②中生成的溶液中加入C时,又有白色沉淀生成,该白色沉淀为硫酸钡,则B为HCl,C为H2SO4,故答案为:Ba(NO3)2;HCl;H2SO4.
点评:本题考查离子反应及气体的制取,注意(一)实验室常用大理石(CaCO3)与稀盐酸或稀硝酸反应制取CO2;常用Zn与稀硫酸或稀盐酸反应制取氢气;
(二)向Na2CO3溶液中加入A,生成白色沉淀,则A为Ba(NO3)2,发生反应:Na2CO3+Ba(NO3)2═BaCO3↓+2NaNO3;加入B时,沉淀溶解,则B为HCl,发生反应:BaCO3+2HCl═BaCl2+H2O+CO2↑,则C为剩余的H2SO4.明确这两点即可解答,题目难度不大,注重基础知识的考查.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
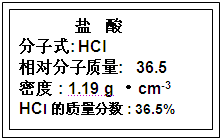
 试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
 _
_ __
__ 反应的离子方程式为____________________________________。
反应的离子方程式为____________________________________。