题目内容
实验:
(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: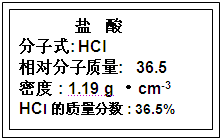
①该浓盐酸中HCl的物质的量浓度为
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体
②若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线
B.忘记将洗涤液加入容量瓶
C.容量瓶内壁附有水珠而未干燥处理
D.溶解后没有冷却便进行定容
(3)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为
③在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL FeCl3饱和溶液,继续煮沸至溶液呈
④另取一小烧杯加入25mL蒸馏水后,向烧杯中再加入2mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到
(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸中HCl的物质的量浓度为
11.9
11.9
mol?L-1.②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BD
BD
.A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体
11.4
11.4
g②若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是
10.6
10.6
g(1g以下用游码)③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
B
B
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线
偏低
偏低
;B.忘记将洗涤液加入容量瓶
偏低
偏低
;C.容量瓶内壁附有水珠而未干燥处理
不变
不变
;D.溶解后没有冷却便进行定容
偏高
偏高
.(3)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为
Fe2O3+6H+=2Fe3++3H2O
Fe2O3+6H+=2Fe3++3H2O
,反应后得到黄色的FeCl3溶液.用此溶液做以下实验:②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为
Fe3++3O H-=Fe(OH)3↓
Fe3++3O H-=Fe(OH)3↓
.③在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL FeCl3饱和溶液,继续煮沸至溶液呈
红褐
红褐
色,即可制得Fe(OH)3胶体.④另取一小烧杯加入25mL蒸馏水后,向烧杯中再加入2mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到
乙
乙
(填甲或乙)烧杯中会产生丁达尔效应.此实验可以区别溶液和胶体
溶液和胶体
.分析:(1)①设溶液的体积为1L,再求出溶质的物质的量,根据C=
求出物质的量浓度;②根据各公式是否与体积有关判断;
(2)①根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3?10H2O的质量;
②根据天平的使用方法是左物右码,可知左盘的质量等于右盘的质量加游码的质量,即物体质量=砝码质量+游码质量;
③根据容量瓶的使用要求;
④根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(3)①根据金属氧化物能与酸反应生成盐和水;
②根据FeCl3溶液能与NaOH溶液发生反应;
③根据制取胶体的实验分析;
④根据胶体有丁达尔效应,而溶液没有.
| n |
| V |
(2)①根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3?10H2O的质量;
②根据天平的使用方法是左物右码,可知左盘的质量等于右盘的质量加游码的质量,即物体质量=砝码质量+游码质量;
③根据容量瓶的使用要求;
④根据c=
| n |
| V |
(3)①根据金属氧化物能与酸反应生成盐和水;
②根据FeCl3溶液能与NaOH溶液发生反应;
③根据制取胶体的实验分析;
④根据胶体有丁达尔效应,而溶液没有.
解答:解:(1)①设盐酸的体积为1L,则溶质的质量为1000mL×1.19g?cm-3×36.5%,溶质的物质的量为
=11.9mol,
所以溶质的物质的量浓度为
=11.9mol/L,故答案为:11.9;
②A、n=CV,所以与溶液体积有关,故A错误;
B、溶液的浓度是均一稳定的,与所取溶液的体积无关,故B正确.
C、N=nNA=CVNA,所以与溶液体积有关,故C错误;
D、溶液的密度是均一的,所以与所取溶液的体积无关,故D正确,
故选:BD;
(2)①因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na2CO3的物质的量n=cV=0.5L×0.08mol?L-1=0.04mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.04mol×286g/mol=11.4g,故答案为:11.4;
②由左盘的质量=右盘的质量+游码的质量可知:砝码质量=物体质量+游码的质量,所以物体质量=砝码质量-游码质量,即:物体质量=11g-0.4g=10.6g.故答案为:10.6;
③用容量瓶配制一定物质的量浓度的溶液,在使用前要先检查是否漏水,容量瓶中无论干燥与否,对实验结果没有影响,但不能用欲配制的溶液润洗过的,会导致误差偏大,故答案为:B;
④A.加水时越过刻度线,溶液的体积偏大,浓度偏小,故答案为:偏低;
B.忘记将洗涤液加入容量瓶,溶质的质量偏小,浓度偏小,故答案为:偏低;
C.容量瓶内壁附有水珠而未干燥处理,溶液的体积不变,浓度不变,故答案为:不变;
D.溶解后没有冷却便进行定容,溶液冷却下来会导致溶液的体积偏小,浓度偏大,故答案为:偏高;
(3)①Fe2O3粉末加入适量盐酸,发生的反应:Fe2O3 +6HCl=2FeCl3 +3H2O,离子方程式为:Fe2O3 +6H+=2Fe3++3H2O,故答案为:Fe2O3 +6H+=2Fe3++3H2O;
②FeCl3溶液中滴入NaOH溶液,发生反应:Fe3++3OH-=Fe(OH)3↓,可观察到有红褐色沉淀Fe(OH)3生成,故答案为:Fe3++3 OH-=Fe(OH)3↓;
③向沸水中滴入几滴FeCl3饱和溶液,继续煮沸至溶液变成红褐色,即可制得氢氧化铁胶体,故答案为:红褐;
④因胶体具有丁达尔效应,而溶液没有丁达尔效应,故答案为:乙;溶液和胶体.
| 1000mL×1.19g?cm -3×36.5% |
| 36.5mol/L |
所以溶质的物质的量浓度为
| 11.9mol |
| 1L |
②A、n=CV,所以与溶液体积有关,故A错误;
B、溶液的浓度是均一稳定的,与所取溶液的体积无关,故B正确.
C、N=nNA=CVNA,所以与溶液体积有关,故C错误;
D、溶液的密度是均一的,所以与所取溶液的体积无关,故D正确,
故选:BD;
(2)①因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na2CO3的物质的量n=cV=0.5L×0.08mol?L-1=0.04mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.04mol×286g/mol=11.4g,故答案为:11.4;
②由左盘的质量=右盘的质量+游码的质量可知:砝码质量=物体质量+游码的质量,所以物体质量=砝码质量-游码质量,即:物体质量=11g-0.4g=10.6g.故答案为:10.6;
③用容量瓶配制一定物质的量浓度的溶液,在使用前要先检查是否漏水,容量瓶中无论干燥与否,对实验结果没有影响,但不能用欲配制的溶液润洗过的,会导致误差偏大,故答案为:B;
④A.加水时越过刻度线,溶液的体积偏大,浓度偏小,故答案为:偏低;
B.忘记将洗涤液加入容量瓶,溶质的质量偏小,浓度偏小,故答案为:偏低;
C.容量瓶内壁附有水珠而未干燥处理,溶液的体积不变,浓度不变,故答案为:不变;
D.溶解后没有冷却便进行定容,溶液冷却下来会导致溶液的体积偏小,浓度偏大,故答案为:偏高;
(3)①Fe2O3粉末加入适量盐酸,发生的反应:Fe2O3 +6HCl=2FeCl3 +3H2O,离子方程式为:Fe2O3 +6H+=2Fe3++3H2O,故答案为:Fe2O3 +6H+=2Fe3++3H2O;
②FeCl3溶液中滴入NaOH溶液,发生反应:Fe3++3OH-=Fe(OH)3↓,可观察到有红褐色沉淀Fe(OH)3生成,故答案为:Fe3++3 OH-=Fe(OH)3↓;
③向沸水中滴入几滴FeCl3饱和溶液,继续煮沸至溶液变成红褐色,即可制得氢氧化铁胶体,故答案为:红褐;
④因胶体具有丁达尔效应,而溶液没有丁达尔效应,故答案为:乙;溶液和胶体.
点评:本题主要考查了一定物质的量浓度溶液的配制以及误差分析,同时考查了铁的化合物的性质,难度不大.

练习册系列答案
相关题目
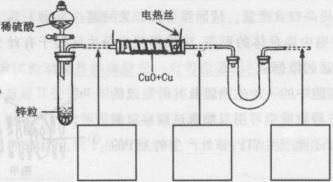
现有氧化铜和铜粉组成的混合物。某同学利用下图所示装置,通过测定混合物质量、实验前后U型管质量变化来确定混合物中氧化铜的质量分数。
 |
回答下列问题:
(1)U形管中可以加入的物质是 (填序号);
A.浓![]() B.无水硫酸铜粉末 C.无水氯化钙颗粒
B.无水硫酸铜粉末 C.无水氯化钙颗粒
(2)下列步骤按实验操作顺序应为 (填字母);
a.停止通氢气;b.电热丝通电;c.通人氢气;d.装置气密性检查;e.电热丝停止通电。
| 实验目的:…… 实验原理:…… 实验仪器和药品:…… 实验装置:…… 实验数据处理:…… 实验误差分析:…… 实验问题讨论:…… |
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;
(4)实验结束后,该同学交给老师的实验报告主要项
目如图(具体内容已略)。请你根据实验报告的撰写要求,
对此份报告作出评价,若已完整,则无需填写,若不完整,请在下面的空格中写出所缺项目 ;
(5)老师看完实验报告后指出,改变实验原理可以设
计出更加简便的实验方案。请用化学方程式表示你设计
的新方案的反应原理 ,该方案需测定的数据 。
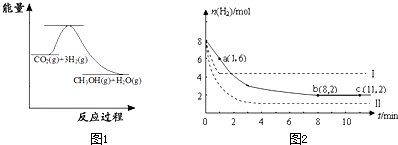
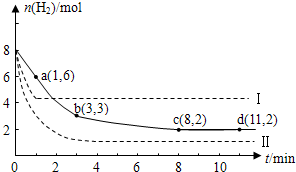 (2011?闵行区二模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
(2011?闵行区二模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
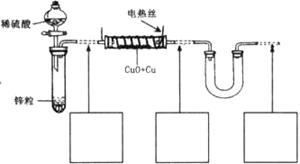
 (3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;