题目内容
【题目】有机物F是有机合成工业中一种重要的中间体.以甲苯和丙烯为起始原料合成F的工艺流程如图: 
回答下列问题:
(1)化合物B中含氧官能团名称是F的结构简式
(2)写出C与银氨溶液共热的化学反应方程式:
(3)化合物D不能发生的反应有(填序号). ①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是(填结构简式).
(5)B与D发生反应的类型 .
【答案】
(1)酚羟基;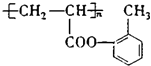
(2)CH2=CHCHO+2Ag(NH3)2OH ![]() CH2=CHCOONH4+2Ag↓+3NH3+H2O
CH2=CHCOONH4+2Ag↓+3NH3+H2O
(3)③⑤
(4)4;![]()
(5)取代反应
【解析】解:(1)由以上分析可知化合物B为 ![]() ,含氧官能团名称是酚羟基,F的结构简式为
,含氧官能团名称是酚羟基,F的结构简式为 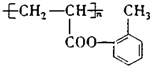 , 所以答案是:酚羟基;
, 所以答案是:酚羟基; 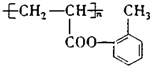 ;(2)C与银氨溶液共热的化学反应方程式:CH2=CHCHO+2Ag(NH3)2OH
;(2)C与银氨溶液共热的化学反应方程式:CH2=CHCHO+2Ag(NH3)2OH ![]() CH2=CHCOONH4+2Ag↓+3NH3+H2O,
CH2=CHCOONH4+2Ag↓+3NH3+H2O,
所以答案是:CH2=CHCHO+2Ag(NH3)2OH ![]() CH2=CHCOONH4+2Ag↓+3NH3+H2O;(3)化合物D为CH2=CHCOOH,含有碳碳双键,可以发生加成反应、氧化反应,能燃烧,属于氧化反应,含有羧基,可以发生取代反应,不能发生消去反应与水解反应,
CH2=CHCOONH4+2Ag↓+3NH3+H2O;(3)化合物D为CH2=CHCOOH,含有碳碳双键,可以发生加成反应、氧化反应,能燃烧,属于氧化反应,含有羧基,可以发生取代反应,不能发生消去反应与水解反应,
所以答案是:③⑤;(4)B为 ![]() ,其同分异构体含苯结构,羟基、甲基还有间位、对位两种,侧链可以为﹣OCH3或﹣CH2OH,符合条件的同分异构体共有4种,其中核磁共振氢铺有4组峰,且不与氯化铁显色的结构为
,其同分异构体含苯结构,羟基、甲基还有间位、对位两种,侧链可以为﹣OCH3或﹣CH2OH,符合条件的同分异构体共有4种,其中核磁共振氢铺有4组峰,且不与氯化铁显色的结构为 ![]() ,
,
所以答案是:4; ![]() ;(5)B为
;(5)B为 ![]() ,D为CH2=CHCOOH,二者发生取代反应生成
,D为CH2=CHCOOH,二者发生取代反应生成 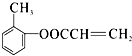 ,
,
所以答案是:取代反应.

 阅读快车系列答案
阅读快车系列答案【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2 . 
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:
(2)气流从左至右,装置接口连接顺序是a
(3)装置C中干燥管中所盛试剂的名称是: , 作用是:
(4)装置D中发生的化学方程式是:
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验: 称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00molL﹣1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl﹣)滴定结果如表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 1.04 | 25.03 |
2 | 1.98 | 25.99 |
3 | 3.20 | 25.24 |
①写出滴定过程中所发生的2个离子方程式 ,
②样品中氯化亚铁的质量分数为 .


