题目内容
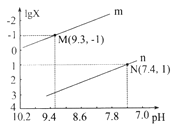
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。
己知:lgX=lg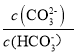 或lg
或lg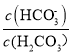 ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与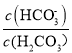 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)= ![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
【答案】C
【解析】A、碳酸钠溶液中滴加盐酸,发生CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,根据图像,推出曲线m表示的是 ,故A错误;B、根据电中性,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),因为溶液显中性,因此c(H+)=c(OH-),即得出c(Na+) =c(HCO3-)+2c(CO32-)+c(Cl-),故B错误;C、n曲线代表的是
,故A错误;B、根据电中性,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),因为溶液显中性,因此c(H+)=c(OH-),即得出c(Na+) =c(HCO3-)+2c(CO32-)+c(Cl-),故B错误;C、n曲线代表的是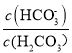 ,根据N点,c(HCO3-)/c(H2CO3)=10,此时c(H+)=10-7.4mol·L-1,根据电离平衡常数的定义,H2CO3的一级电离平衡常数为
,根据N点,c(HCO3-)/c(H2CO3)=10,此时c(H+)=10-7.4mol·L-1,根据电离平衡常数的定义,H2CO3的一级电离平衡常数为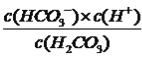 =10×10-7.4=10-6.4,故C正确;D、该反应的平衡常数为
=10×10-7.4=10-6.4,故C正确;D、该反应的平衡常数为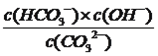 ,根据M点,c(HCO3-)/c(CO32-)=10,c(H+)=10-9.3mol·L-1,c(OH-)=10-4.7mol·L-1,代入数值,得出此反应的化学平衡常数为10-3.7,故D错误。
,根据M点,c(HCO3-)/c(CO32-)=10,c(H+)=10-9.3mol·L-1,c(OH-)=10-4.7mol·L-1,代入数值,得出此反应的化学平衡常数为10-3.7,故D错误。

【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性强弱相差很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可知它们的结构式分别为①__________,②__________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①__________,②__________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况__________,写出反应的化学方程式________________________________________________________________________。