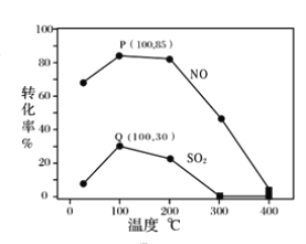
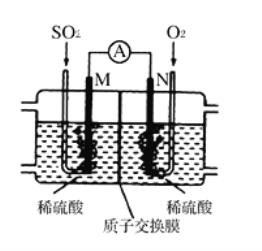
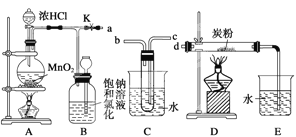
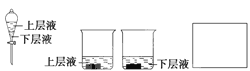
题目内容
【题目】下列四种装置中,溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
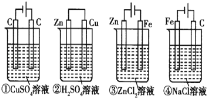
A. 工作一段时间后溶液的浓度:①=②=③=④
B. 工作一段时间后溶液的pH:④>③>①>②
C. 产生气体的总体积:④>③>①>②
D. 电极上析出固体的质量:①>②>③>④
【答案】B
【解析】
①③④是电解池②原电池,①是电解硫酸铜溶液,溶液中的氢氧根离子失去电子产生氧气,溶液中的铜离子得到电子在阴极析出铜单质,溶液最后呈碱性;②是原电池锌做负极失去电子溶液中的氢离子在正极得到电子变为氢气,最后的溶液呈酸性③是电解池锌在阳极失去电子,溶液中的氢离子在阴极得到电子,最后溶液呈碱性④是电解饱和食盐水,氯离子在阳极失去电子产生氯气,溶液中的氢离子在阴极得到电子产生氢气,最后溶液呈碱性,所以A错误,产生气体的总体积的大小关系为④>①=②=③,C错误;只有①中电极上有固体析出,其它电极上没有固体析出,所以D错误;溶液的PH大小关系为④>③>①>②。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目