题目内容
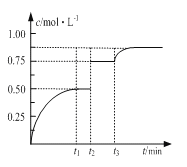
【题目】常温下,向25mL 0.1 mol·L-1 MOH 溶液中逐滴加入0.2 mol·L-1 HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)MOH与HA恰好完全反应时,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示其原因 。
此时,混合溶液中由水电离出的c(H+) 0.2mol.L-1 HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(2)D点时,溶液中c(A-)+c(HA) 2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则c(HA)+c(H+)= mol·L-1(数字表达式,不必具体算出结果)。
(3)分别写出C点混合溶液中各离子浓度的大小关系 。
【答案】
(1)碱;A-+H2O![]() HA+OH-;>;
HA+OH-;>;
(2)=;(5×10-2+10-11)
(3)c(A-)>c(M+)>c(H+)>c(OH-)
【解析】
试题分析:(1)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2OHA+OH-,促进水的电离,则混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+),故答案为:碱;A-+H2O![]() HA+OH-;>;
HA+OH-;>;
(2)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+);c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+)可得:c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L,故答案为:=;0.05+10-11;
(3)B点溶液呈中性,溶液中存在c(M+)=c(A-)>c(H+)=c(OH-),C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,应存在c(A-)>c(M+)>c(H+)>c(OH-),故答案为: c(A-)>c(M+)>c(H+)>c(OH-)。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案