题目内容
【题目】H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1) H2O2溶液显弱酸性,测得0.15 mol·L1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式: 。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:
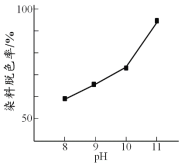
由上图可得到的结论是 ,结合平衡移动原理简述理由: 。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L1 | 0.07 mol·L1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2—+H2O2=H2O+O2+OH—。
①结合离子方程式解释1小时后pH没有明显变化的原因: 。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因: 。
【答案】
(1)H2O2![]() HO2-+ H+
HO2-+ H+
(2)结论:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;
原因:c(OH-)增大,促使H2O2![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好
(3)① 碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O + O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变② pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低;
【解析】
试题分析:(1)H2O2生成HO2—的电离方程式为H2O2![]() HO2-+ H+,故答案为:H2O2
HO2-+ H+,故答案为:H2O2![]() HO2-+ H+;
HO2-+ H+;
(2)根据图像可知,其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;因为c(OH-)增大,促使H2O2![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好,故答案为:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好,故答案为:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好;
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好;
(3)①碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O + O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变,故答案为:碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O + O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变;②pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低,故答案为:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低。