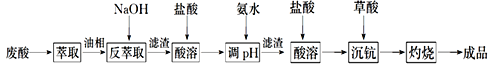
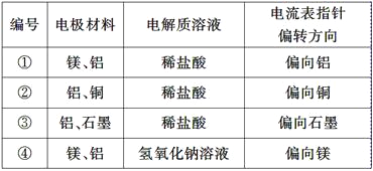
��Ŀ����
����Ŀ���±������ڱ��е�һ���֣�����A��I�����ڱ��е�λ�ã���(1)~ (4)С����Ԫ�ط��Ż�ѧʽ�ش𣬣�5������8��С�ⰴ��ĿҪ��ش�
�� | I A | �� A | �� A | �� A | �� A | �� A | �� A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)����Ԫ�أ���ѧ��������õ��� ��ֻ�и��۶������۵��� ����������ǿ�ĵ����� ����ԭ����ǿ�ĵ����� ��
(2)����������ˮ���������ǿ���� ��������ǿ���� �������Ե��� ��
(3)A�ֱ���D��E��F��G��H�γɵĻ������У����ȶ��� ��
(4)��B��C��E��F��G��H�У�ԭ�Ӱ뾶������ ��
��5��A��D��ɻ�����ĵ���ʽ ��
��6��A��E��ɻ�����Ļ�ѧʽ ��
��7���õ���ʽ��ʾB��H��ɻ�������γɹ��� ��
��8��B������������ˮ�����C��������������Ӧ�����ӷ���ʽ
��
���𰸡���15�֣���1��Ne��F��F2��Na ��ÿ��1�֣���4�֣�
��2��NaOH��HClO4��Al(OH)3 ��ÿ��1�֣���3�֣�
��3��HF ��1�֣� ��4��Na ��1�֣� ��5��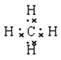 ����6��NH3��
����6��NH3��
��7��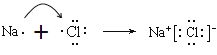 ����2�֣�
����2�֣�
��8��Al��OH��3 + OH���� AlO2�� + 2H2O ��2�֣�
�����������⣺����A��Iʮ��Ԫ�������ڱ��е�λ�ÿ�֪�����Ƿֱ���H��Na��Al��C��N��P��F��Ne������Ԫ�������ɿ�֪��
��1����ѧ��������õ���Ne��ֻ�и��۶������۵���F����������ǿ�ĵ�����F2����ԭ����ǿ�ĵ�����Na��
��2�������Ի�ǽ�����Խǿ������������ˮ����ļ��Ի�����Խǿ��������������ˮ���������ǿ����NaOH��������ǿ����HClO4�������Ե���Al(OH)3��
��3���ǽ�����Խǿ���⻯����ȶ���Խǿ������⻯�����ȶ�����HF��
��4��ͬһ����Ԫ�ش��ϵ���ԭ�Ӱ뾶������ͬ�����������ң�ԭ�Ӱ뾶��С��������B��C��E��F��G��H�У�ԭ�Ӱ뾶������Na��
��5��A��D��ɻ������Ǽ��飬���м��Լ��Ĺ��ۻ���������ʽΪ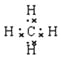 ��
��
��6��A��E��ɻ�����Ļ�ѧʽ��NH3��
��7��B��H��ɻ������Ȼ��ƣ����γɹ��̿ɱ�ʾΪ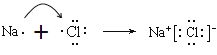 ��
��
��8������������������������ܺ�����������Һ��Ӧ����B������������ˮ�����C��������������Ӧ�����ӷ���ʽAl��OH��3 + OH���� AlO2�� + 2H2O��