题目内容
资料显示:在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4 ,从而减少SO2排放,该方法被称为钙基固硫。这一过程是通过以下两步反应实现的:
㈠ CaCO3 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。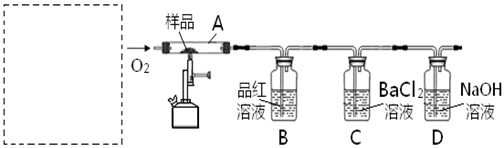
已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物
Ⅱ---CaSO4粉末
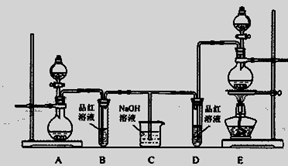
(1)实验一:①取样品Ⅰ装入A中。连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊。停止该步实验的正确操作是 。
②取反应后D中溶液滴加过量盐酸,无明显现象。由此得知实验一过程中: A中发生反应的化学方程式是 ;C中反应的离子方程式是 。
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是 。
a.酚酞的NH3·H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中。连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应。发现B中红色消失,C中出现白色浑浊。
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是 。
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现。
由此得知实验二: A中发生的反应有 (填选 “㈠”、“㈡”)。
(3)实验三:取样品Ⅱ装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是 。比较实验一、二、三可知,如用该方法固硫,可行的基本条件是 。
(4)在中学化学实验室里,装置A通常只能选 为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是: 。
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置。请将该药品和装置图示在图中的虚线框内。
① 撤掉喷灯,继续通入O2至A冷却
② S +O2  SO2 2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+
SO2 2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+
③ a、b(2)② CO32-+2H+=CO2 ↑+H2O③ (一)、(二)
(3)2CaSO4 2CaO+2SO2↑+O2 ↑ 燃烧温度需1000℃左右
2CaO+2SO2↑+O2 ↑ 燃烧温度需1000℃左右
(4)石英 , SiO2+CaO  CaSiO3(2分)
CaSiO3(2分)
(5)图略(装置+药品)
解析试题分析:(1)实验一:①取S粉与CaCO3粉末的混合物高温灼烧,有SO2产生,C中产生硫酸钡沉淀,D用来吸收过量的SO2,停止实验时,为了避免倒吸,撤掉酒精喷灯以后,要持续通氧气一直到冷却。②取反应后D中溶液滴加过量盐酸,无明显现象,说明没有CO2生成,CaCO3粉末没有分解,只有硫燃烧生成了SO2,C中SO2被氧气氧化产生硫酸钡沉淀,③要获得与以上实验事实相一致的结论,可替代B中品红溶液的用酚酞的NH3·H2O溶液,红色褪去,a正确;b.酸性KMnO4溶液,紫色褪去,正确;c.酚酞的NaHCO3溶液,亚硫酸酸性比碳酸强,会产生CO2,NaOH溶液会吸收CO2,加盐酸有气体产生,错误;d.Br2的CCl4溶液,与SO2不反应,无现象,错误。(2)实验二控制温度在1000℃左右,CaCO3粉末分解,硫燃烧生成了SO2,D中溶液吸收CO2,产生碳酸盐,加入盐酸有大量气泡。(3)实验三:取样品CaSO4粉末装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,说明CaSO4分解,有SO2生成,因此用此方法固硫时,温度应选择实验二的温度,过低CaCO3粉末没有分解,过高CaSO4分解又有SO2生成,不能起到固硫的作用。(4)在中学化学实验室里,装置A通常选择石英材料,但是SiO2和CaO在高温下会反应。(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有NaOH的洗气瓶,除去空气中的CO2。
考点:考查元素化合物的性质、物质的制备、实验基本操作、实验装置

根据下列框图,有关说法正确的是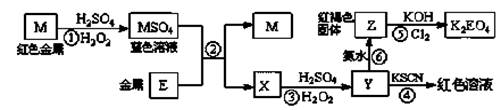
| A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O =3EO4 2―+ 6Cl― +12H+ |
| C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
| D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为: |
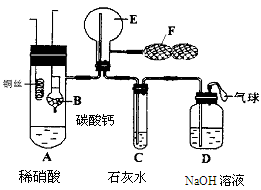
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
| A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
| B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
| C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |
| D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |


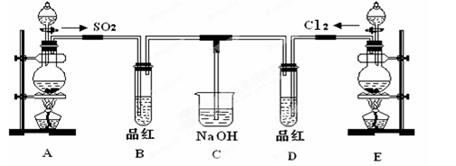
 MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是 