题目内容
金属铜的导电性仅次于银,大量用于电气工业。
(1)写出铜的基态原子价电子电子排布式________。
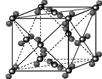
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学 式为__________。

(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2。晶体。氨分子中N原子的杂化方式为____________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比PH3大,其原因是_________________________________.
(1)写出铜的基态原子价电子电子排布式________。
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学 式为__________。

(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2。晶体。氨分子中N原子的杂化方式为____________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比PH3大,其原因是_________________________________.
(8分)
(1)3d104s1 (2分)
(2)CuCl(1分)
(3) sp3(1分);离子键(1分);配位键(1分)
(4)NH3分子之间有氢键作用,故沸点明显高于PH3(2分)
(1)3d104s1 (2分)
(2)CuCl(1分)
(3) sp3(1分);离子键(1分);配位键(1分)
(4)NH3分子之间有氢键作用,故沸点明显高于PH3(2分)
试题分析:
(1)铜的基态原子价电子电子排布式3d104s1。
(2)氯原子数为1/8×8+1/2×6=4,铜原子数为1×4=4,所以为CuCl。
(3)氨分子中N原子的价电子对为(5+3)/2=4,所以杂化方式为sp3;深蓝色晶体中含有的化学键除普通共价键外,还有离子键和配位键。
(4)N-H键具有较强的极性,分子间形成氢键。

练习册系列答案
相关题目






 键有________mol。
键有________mol。
