题目内容
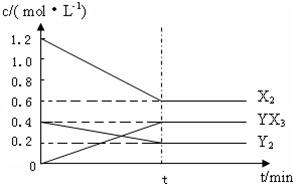
一定条件下,容积为2 L的密闭容器中,通入2 mol N2、3 mol H2进行反应N2(g)+3H2(g)
 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是(
)
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是(
)
A.1 h后反应进行完全,容器中的N2浓度为0.55 mol·L-1
B.前20 min用NH3表示的反应速率为0.01 mol·L-1·min-1
C.增加H2的浓度或降低温度,平衡将向正反应方向移动,且反应速率均加快
D.当容器内压强不改变时,说明反应已达到平衡状态
D
【解析】
试题分析:
N2 + 3H2 2NH3
2NH3
起始量(mol) 2 3 0
转化量(mol) x 3x 2x
1h后(mol) 2-x 3-3x 2x
(2-x+3-3x+2x)/5 = 0.8 x=0.5
A、1h后氮气浓度为(2-0.5)/2=0.75mol/L,错误;B、前20min氮气的速率为:0.0025mol/(L.min),错误;C、降低温度,反应速率减慢,错误;D、体系压强不变则达到平衡状态,正确。
考点:本题考查了化学平衡计算。

(8分)一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2  N2O4。反应中测得相关数据如下表所示:
N2O4。反应中测得相关数据如下表所示:
|
反应时间/min |
0 |
10 |
20 |
30 |
40 |
50 |
|
气体相对分子质量 |
46 |
57 |
64 |
69 |
69 |
69 |
(1)此条件下该反应的化学平衡常数Kc=________。(填表达式)
(2)在50 min末,向容器中加入 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
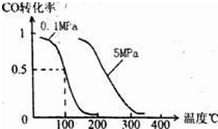
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。

(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率α=________。
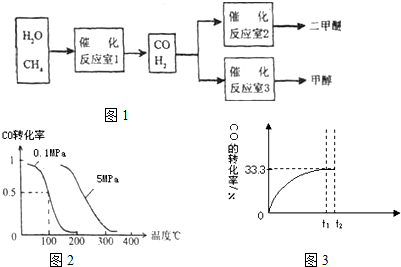
 (1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0