题目内容
【题目】科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H=a kJ·mol-1
CH2=CH2(g)+4H2O(g) △H=a kJ·mol-1
⑴已知:①H2和CH2=CH2的燃烧热(△H)分别为-285.8kJ·mol-1和-1411kJ·mol-1
②H2O(g)= H2O(l) △H=-44 kJ·mol-1 则a= kJ·mol-1。
⑵不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是______(填序号)。
①不同条件下反应,N点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④实际反应应尽可能在较低的温度下进行,以提高
CO2的转化率
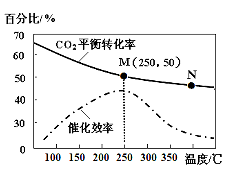
⑶若在密闭容器中充入体积比为 3∶1的 H2 和CO2,则图中M点时,产物CH2=CH2的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
⑷科学家开发了一种新型陶瓷(主要成分为Li4SiO4),在500℃时可高效吸收CO2,同时生成 Li2CO3;该材料在700℃时可再生循环。请写出表示该过程的化学方程式____________________。
【答案】⑴-127.8(2分)⑵①②④(2分)
⑶7.7% (2分)增大压强(降低温度)(1分)
⑷CO2+Li4SiO4![]() Li2CO3+Li2SiO3(2分)
Li2CO3+Li2SiO3(2分)
【解析】
试题分析:(1)H2和CH2=CH2的燃烧热分别为285.8kJ/mol和1411kJ/mol,热化学方程式为:
①H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(l),△H=-1411kJ/mol
③H2O(g)=H2O(l)△H=-44kJ/mol
盖斯定律计算①×6-②-③×4得到:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8kJ/mol;
CH2=CH2(g)+4H2O(g)△H=-127.8kJ/mol;
(2)①化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故①不正确;②温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故②不正确;③升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故③正确;④为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故④不正确;故答案为:①②④;
(3)若在密闭容器中充入体积比为 3:1的 H2 和CO2,设为3mol,1mol,则图中M点时二氧化碳转化率50%,
6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
起始量(mol) 3 1 0 0
变化量(mol) 1.5 0.5 0.25 1
平衡量(mol) 1.5 0.5 0.25 1
产物CH2=CH2的体积分数=0.25/(1.5+0.5+0.25+1)×100%=7.7%;反应前后气体体积减小,若要进一步提高乙烯的体积分数,可采取的措施有增大压强平衡正向进行;
(4)科学家开发了一种新型陶瓷(主要成分为Li4SiO4),在500℃时可高效吸收CO2,同时生成 Li2CO3,该材料在 700℃时可再生循环,反应的化学方程式为CO2+Li4SiO4![]() Li2CO3+Li2SiO3。
Li2CO3+Li2SiO3。