题目内容
【题目】下列图示与对应的叙述相符的是( )
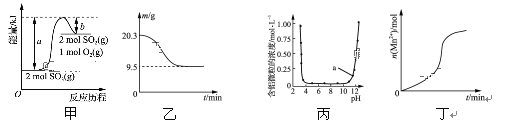
A. 由图甲可知,2SO3(g)![]() 2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
B. 图乙表示0.1 mol MgCl2·6H2O在空气中充分加热时残留固体质量随时间的变化
C. 图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中存在大量Al3+
D. 图丁表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1的H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对反应有催化作用)
【答案】D
【解析】
A. 由图甲可知,该反应为吸热反应,其焓变为:(a-b)kJ·mol-1,故A错误;
B.0.1 mol MgCl2·6H2O在空气中充分加热时残留固体应为MgO,质量为4.0g,故B错误;
C.在强碱性条件下,铝元素以偏铝酸根离子形式存在,图中a点溶液中应存在大量AlO2-,故C错误;
D. 酸性KMnO4溶液与H2C2O4溶液混合时,由于被还原生成的Mn2+对反应有催化作用,则反应开始速率较慢,后速率迅速变快,最后由于浓度减小,反应速率又变慢,故D符合题意;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡 常数 | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是( )
A. K1=12.8
B. T1<T2
C. T1℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D. 若在T2温度下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率小于40%