题目内容
A、B、C、D、E是原子序数递增的五种短周期元素,其中A元素组成的一种粒于不含电子;B元素的最高价氧化物的水化物甲能与其氢化物生成一种盐乙;D的单质能与酸、碱反应均生成氢气;A、B、D三种元素都能与C元素形成常见化舍物;D、E两种元素组成DE3型化合物,(1)写出由以上某些元素构成的既含极性共价键,又含非极性共价键的化台物的电子式: (写出一种即可)
(2)B的常见氢化物的空间构型是 .
(3)常温下1克A单质在足量C单质中燃烧生成稳定的液态物质释放出142.9kJ热量,写出表示A单质燃烧热的热化学方程式: ;
(4)A单质和C单质在浓KOH溶液做电解质溶液时可形成原电池,写出该电池中正极的电极反应方程式: ;
(5)常温下,甲、乙的水溶液的pH均为5.则两溶液中由水电离出的H+浓度之比是 ;
(6)由上述元素所形成的常见物质X、Y、Z、W、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为 ;
②M→N的化学反应方程式为 .
【答案】分析:A元素组成的一种粒于不含电子,只有H+符合,则A为H元素;B元素的最高价氧化物的水化物甲能与其氢化物生成一种盐乙,则乙应为NH4NO3,B为N元素,D的单质能与酸、碱反应均生成氢气,应为Al元素;D、E两种元素组成DE3型化合物,则E应为Cl元素,A、B、D三种元素都能与C元素形成常见化舍物,结合原子序数可知C为O元素,结合对应物质的性质解答该题.
解答:解:A元素组成的一种粒于不含电子,只有H+符合,则A为H元素;B元素的最高价氧化物的水化物甲能与其氢化物生成一种盐乙,则乙应为NH4NO3,B为N元素,D的单质能与酸、碱反应均生成氢气,应为Al元素;D、E两种元素组成DE3型化合物,则E应为Cl元素,A、B、D三种元素都能与C元素形成常见化舍物,结合原子序数可知C为O元素,则
(1)由以上某些元素构成的既含极性共价键,又含非极性共价键的化台物为H2O2,电子式为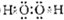 ,
,
故答案为: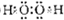 ;
;
(2)B为N元素,对应的氢化物为NH3,空间结构为三角锥形,故答案为:三角锥形;
(3)n(H2)=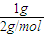 =0.5mol,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,
=0.5mol,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,
反应的热化学方程式为H2(g)+ O2(g)=H2O(l)△H=-285.8kJ/mol,
O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+ O2(g)=H2O(l)△H=-285.8kJ/mol;
O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)碱性氢氧燃料电池中,O2在正极上得电子生成0H-,电极反应式为O2+2H2O+4e-=40H-,
故答案为:O2+2H2O+4e-=40H-;
(5)甲为HNO3,抑制水的电离,乙为NH4NO3,NH4+水解促进水的电离,甲、乙的水溶液的pH均为5.则两溶液中由水电离出的H+浓度之比是10-9:10-5=10-4:1,
故答案为:10-4:1;
(6)上述元素对应的金属元素只有Al,则N为Al,M为Al2O3,Z为Al(OH)3,W应为铵盐,为AlCl3或Al(NO3)3与氨水的反应,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,工业常用电解Al2O3的方法冶炼Al,反应的化学方程式为2Al2O3 4Al+3O2↑,
4Al+3O2↑,
故答案为:①Al3++3NH3?H2O=Al(OH)3↓+3NH4+;②2Al2O3 4Al+3O2↑.
4Al+3O2↑.
点评:本题考查无机物的推断以及元素周期表与周期律的综合应用,题目考查角度较多,题目难度较大,注意把握相关物质的性质,为解答该题的关键.
解答:解:A元素组成的一种粒于不含电子,只有H+符合,则A为H元素;B元素的最高价氧化物的水化物甲能与其氢化物生成一种盐乙,则乙应为NH4NO3,B为N元素,D的单质能与酸、碱反应均生成氢气,应为Al元素;D、E两种元素组成DE3型化合物,则E应为Cl元素,A、B、D三种元素都能与C元素形成常见化舍物,结合原子序数可知C为O元素,则
(1)由以上某些元素构成的既含极性共价键,又含非极性共价键的化台物为H2O2,电子式为
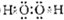 ,
,故答案为:
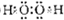 ;
;(2)B为N元素,对应的氢化物为NH3,空间结构为三角锥形,故答案为:三角锥形;
(3)n(H2)=
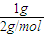 =0.5mol,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,
=0.5mol,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,反应的热化学方程式为H2(g)+
 O2(g)=H2O(l)△H=-285.8kJ/mol,
O2(g)=H2O(l)△H=-285.8kJ/mol,故答案为:H2(g)+
 O2(g)=H2O(l)△H=-285.8kJ/mol;
O2(g)=H2O(l)△H=-285.8kJ/mol;(4)碱性氢氧燃料电池中,O2在正极上得电子生成0H-,电极反应式为O2+2H2O+4e-=40H-,
故答案为:O2+2H2O+4e-=40H-;
(5)甲为HNO3,抑制水的电离,乙为NH4NO3,NH4+水解促进水的电离,甲、乙的水溶液的pH均为5.则两溶液中由水电离出的H+浓度之比是10-9:10-5=10-4:1,
故答案为:10-4:1;
(6)上述元素对应的金属元素只有Al,则N为Al,M为Al2O3,Z为Al(OH)3,W应为铵盐,为AlCl3或Al(NO3)3与氨水的反应,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,工业常用电解Al2O3的方法冶炼Al,反应的化学方程式为2Al2O3
 4Al+3O2↑,
4Al+3O2↑,故答案为:①Al3++3NH3?H2O=Al(OH)3↓+3NH4+;②2Al2O3
 4Al+3O2↑.
4Al+3O2↑.点评:本题考查无机物的推断以及元素周期表与周期律的综合应用,题目考查角度较多,题目难度较大,注意把握相关物质的性质,为解答该题的关键.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
