题目内容
【题目】某同学利用CuSO4溶液,进行以下实验探究。
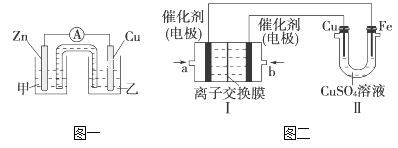
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
【答案】 Cu2++2e-=Cu 乙 O2 CH4-8e-+10OH-=CO32—+7H2O 0.28
【解析】(1)负极为Zn,Cu为正极,正极上铜离子得到电子发生还原反应,电极反应为Cu2++2e-=Cu;溶液中阳离子向正极移动,即K+向乙中移动;(2)铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,即b处通入O2,a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O;当铜电极的质量减轻3.2g,则n(Cu)=3.2g÷64g/mol=0.05mol,已知Cu电极的反应为Cu-2e-=Cu2+,所以转移电子为0.1mol,燃料电池中CH4-8e-+10OH-=CO32-+7H2O,则n(CH4)=1/8n(e-)=0.125mol,所以消耗的CH4在标准状况下的体积为0.125mol×22.4L/mol=0.28L。

练习册系列答案
相关题目




