题目内容
【题目】由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x.将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持120℃、1.01×105Pa.收集所得气体,冷却、称量,真空管中固体质量增加y g.
(1)若a=1,则y=(用含x代数式表示);
(2)若a=2,x=0.5时,反应后所得气体的成份是;
(3)若a=2,y=28时,则x的取值范围;
(4)若a=1.25,试作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值.
【答案】
(1)26x+2
(2)氧气、水
(3)0.5≤x<1
(4)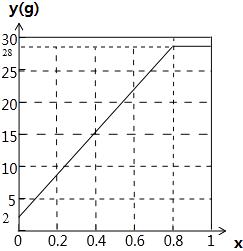
【解析】解:(1)由反应2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑可知,气体与过氧化钠都按1:1反应,a=1时,混合气体与过氧化钠恰好反应,n(CO2)=ax=x,固体增重为y=28n(CO2)+2[1﹣n(CO2)]=28x+2(1﹣x)=26x+2,所以答案是:26x+2;(2)a=2,x=0.5时,n(CO2)=1mol,二氧化碳与过氧化钠恰好反应,水不反应,从Na2O2的真空管出来的气体有氧气、水蒸气,所以答案是:氧气、水;(3)a=2,y=28时,若x≥0.5,水不参加反应,根据过氧化钠计算增重为y=28n(Na2O2)=28,故0.5≤x<1,固体增重28g;若<0.5,二氧化碳完全反应,参加反应的水为[1﹣n(CO2)]mol,所以固体增重为y=28n(CO2)+2[1﹣n(CO2)]=28×2x+2(1﹣2x)=28,解得x=2,不符合题意,所以答案是:0.5≤x<1;(4)当a=1.25时,若x≥0.8,水不参加反应,根据过氧化钠计算增重为y=28n(Na2O2)=28;若x<0.8,二氧化碳完全反应,参加反应的水为[1﹣n(CO2)]mol,所以固体增重为y=28n(CO2)+2[1﹣n(CO2)]=28×2x+2(1﹣2x)=52x+2,当x=0时中含有氢气,y=2,y与x的关系曲线图为:

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的单质为密度最小的气体 |
Y | Y的氢化物的水溶液呈碱性 |
Z | Z是地壳中含量最高的元素 |
W | W的一种核素的质量数为35,中子数为18 |
(1)W在元素周期表中的位置_________________。
(2)X与Y可形成一种化合物Y2X4,请写出该化合物的电子式__________,工业合成Y的简单氢化物的化学方程式为________________。
(3)X和Z组成的既含有极性共价键又含有非极性共价键的化合物的结构式是______________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为______________
(4)写出铜和Y的最髙价氧化物的水化物的稀溶液反应的离子方程式______________。
(5)W最高价氧化物的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子发生转移时,共产生9 mol气体,写出该反应的化学方程式______________。