��Ŀ����
�¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g) PCl3(g)��Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ���������ͼ��
PCl3(g)��Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ���������ͼ��
����˵����ȷ����
| A����Ӧ��ǰ50 s ��ƽ������v(PCl3)��0.0032 mol��L��1��s��1 |
| B�����������������䣬�����¶ȣ�ƽ��ʱc(PCl3)��0.11mol��L��1����Ӧ�ġ�H��0 |
| C����ͬ�¶��£���ʼʱ�������г���2.0 mol PCl3��2.0mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80% |
| D����ͬ�¶��£���ʼʱ�������г���1.0 mol PCl5��0.20mol PCl3��0.20 mol Cl2����Ӧ�ﵽƽ��ǰv(��)��v(��) |
D
�������������A����Ӧ��ǰ50 s ��ƽ������v(PCl3)��0.16��2��50="0.0016" mol��L��1��s��1,����B��ƽ��ʱc(PCl3)��0.20��2=0.10mol��L��1�������¶���Ũ������ƽ�������ƶ�����Ӧ���ȣ�����C����ͬ�¶��£���ʼʱ�������г���1.0 mol PCl3��1.0 mol Cl2ʱ��Ԫƽ��Ϊ��Чƽ�⣬ PCl3��ת����С��80% ������2.0 mol PCl3��2.0 mol Cl2��ѹǿ����ƽ��������PCl5�����ƶ���PCl3��ת����������
PCl5(g) PCl3(g)��Cl2(g)
PCl3(g)��Cl2(g)
ʼ�� 1 0 0
ת���� 0.2 0.2 0.2
ƽ���� 0.8 0.2 0.2
k=(0.2/2��0.2/2)��0.8/2=0.025
��ʱŨ����Q=(0.2/2��0.2/2)��1.0/2=0.02��0.025��ƽ�������ƶ���v(��)��v(��)����ȷ��
���㣺���黯ѧƽ���й����⡣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���9�֣�����������������OH-�����·���ˮ�ⷴӦ��O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| ��/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
��2����ʽ����15 ��ʱ�÷�Ӧ��ƽ�ⳣ��_________________��
��3��Ϊ���O2NC6H4COOC2H5��ƽ��ת���ʣ������ʵ����Ʒ�Ӧ�¶��⣬�����Բ�ȡ�Ĵ�ʩ��_________��Ҫ��д����������
��ҵ������Ĺ��������÷�Ӧ2SO2(g)��O2(g) 2SO3(g)+Q (Q��0)����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
2SO3(g)+Q (Q��0)����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
��1��д���ÿ��淴Ӧ�Ļ�ѧƽ�ⳣ������ʽ ��
��2��һ�������£���һ���������ܱ������г���2molSO2��1molO2������Ӧ������˵���У���ȷ���� (����)��
a������Ӧ���ʦ���(O2)=2����(SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
b�������¶Ⱥ�����������䣬����2 mol N2����ѧ��Ӧ���ʼӿ�
c��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
d��ƽ��������¶ȣ�ƽ�ⳣ��K����
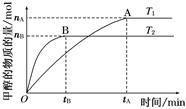
��һ������SO2(g)��O2(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
��3��ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ����(SO2)��ʾ�ķ�Ӧ����Ϊ ��
T1 T2 (ѡ���������������=��)�������� ��β��SO2��NaOH��Һ���պ������Na2SO3�����г�����0.1mol/LNa2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
��4������Һ��c(Na+)�� c(OH��)֮��Ϊ ��
����Һ��c(OH��)= c(H+)+ + ������Һ����������Ũ�ȱ�ʾ����
��5������ú������ʵ������ʵ����и���Һ�ֱ�������SO2���������������ɶൽ�ٵ�˳���� (�ñ������)
A��Na2SO3 B��Ba(NO3)2 C��Na2S D������KMnO4
 �����ᷴӦ�Ļ�ѧ����ʽ��______________________.
�����ᷴӦ�Ļ�ѧ����ʽ��______________________.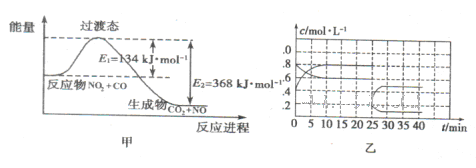
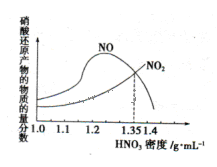
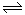 N2O4(g) ��H<0���ֽ�һ������NO2��N2O4�������ͨ�����Ϊ1L�ĺ����ܱ������з���������Ӧ����Ӧ���Ũ����ʱ�ʱ仯��ϵ��ͼ����ʾ��
N2O4(g) ��H<0���ֽ�һ������NO2��N2O4�������ͨ�����Ϊ1L�ĺ����ܱ������з���������Ӧ����Ӧ���Ũ����ʱ�ʱ仯��ϵ��ͼ����ʾ��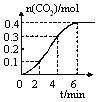
 pC(��) + qD(��)�� C %��ʱ�� t����ͼ��ϵ
pC(��) + qD(��)�� C %��ʱ�� t����ͼ��ϵ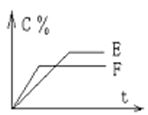
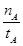 mol��L��1��min��1
mol��L��1��min��1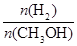 ����
���� C(g)��D(g)�����е������仯��ͼ��ʾ���ش��������⡣
C(g)��D(g)�����е������仯��ͼ��ʾ���ش��������⡣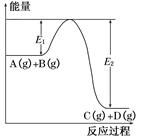
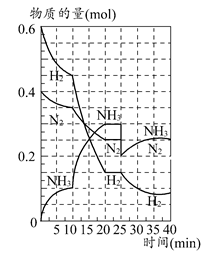
 2NH3��ƽ�ⳣ��K����ֵΪ________�������¶Ȳ��䣬��Ӧ������25 minʱ����ȥ0.1 mol������ʱƽ�ⳣ��K��________(�������С�����䡱)������������䣬�ﵽ��ƽ��������Ӧ�Ļ�ѧ��Ӧ���ʱ�ԭƽ��״̬________(���С�����䡱)��
2NH3��ƽ�ⳣ��K����ֵΪ________�������¶Ȳ��䣬��Ӧ������25 minʱ����ȥ0.1 mol������ʱƽ�ⳣ��K��________(�������С�����䡱)������������䣬�ﵽ��ƽ��������Ӧ�Ļ�ѧ��Ӧ���ʱ�ԭƽ��״̬________(���С�����䡱)��