题目内容
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1H < 0(I)
NaNO3(s)+ClNO(g) K1H < 0(I)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2H < 0(II)
2ClNO(g) K2H < 0(II)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=8.0×10-3molL-1min-1,回答下列问题
①平衡后n(Cl2)=__________mol,
②NO的转化率а1=_______。
③其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2________а1(填“>”“<”或“=”),平衡常数K2___________(填“增大”“减小”或“不变”)。
④若要使K2减小,可采用的措施是________________________。
【答案】 K12/K2 2.0×10-2 80% > 不变 升高温度
【解析】试题分析:(1)反应①的化学平衡常数=c(ClNO)/c2(NO2),反应②的平衡常数=c2(ClNO)/c2(NO)c(Cl2),反应③平衡常数=c(Cl2)c2(NO)/c4(NO2),所以计算K=(K1)2/K2.(2)
2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始量0.2 0.1 0
变化量 0.15 0.075 0.15
平衡量 0.05 0.025 0.15 ,则平衡后氯气的物质的量为2.5× 10-2mol;一氧化氮的转化率="0.15/0.2=" 75%;其他条件保持不变,反应(II)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器的体积减小,压强比恒容容器大,平衡正向移动,平衡时一氧化氮的转化率增大,平衡常数随温度变化,不随浓度或压强变化,若要是平衡常数减小,平衡逆向移动,反应是放热的,所以可以选择升高温度。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
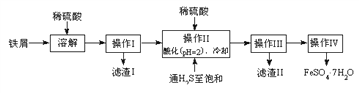
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)