题目内容
17.将c mol/L的AlCl3溶液V1mL加水稀释至V2mL,稀释后溶液中Cl-物质的量浓度为 ( )| A. | c mol/L | B. | 3c mol/L | C. | $\frac{3c{V}_{1}}{{V}_{2}}$mol/L | D. | $\frac{c{V}_{1}}{{V}_{2}}$mol/L |
分析 c mol/L的AlCl3溶液中Cl-物质的量浓度为3c mol/L,再根据稀释定律计算稀释后溶液中Cl-物质的量浓度.
解答 解:c mol/L的AlCl3溶液中Cl-物质的量浓度为3c mol/L,根据稀释定律,稀释后溶液中Cl-物质的量浓度为$\frac{{V}_{1}mL×3cmol/L}{{V}_{2}mL}$=$\frac{3c{V}_{1}}{{V}_{2}}$mol/L,故选:C.
点评 本题考查物质的量浓度计算,注意对定义式的理解与灵活应用,比较基础.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
7.下列说法中不正确的是( )
| A. | 三氧化二铝属于两性氧化物 | |
| B. | 用热的纯碱溶液洗涤沾有油污的物品时,发生的主要是化学变化 | |
| C. | 液氨、液氯、液态氯化氢都是非电解质 | |
| D. | 光导纤维的基本原料为SiO2 |
8.甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
则△H1=-99kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
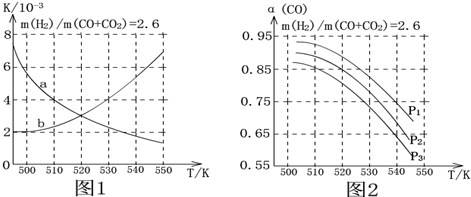
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
12.某有机物分子式为C4H8,据此推测其结构和性质不可能的是( )
| A. | 含有3个甲基 | B. | 一氯代物只有一种 | ||
| C. | 使溴水褪色 | D. | 四个碳原子共平面 |
9.常温下,0.1mol•L-1 ROH溶液的pH=12.下列有关说法正确的是( )
| A. | c(OH-)=c(R+)=0.01mol•L-1 | B. | c(R+)>c(H+) | ||
| C. | c(ROH)<c(R+) | D. | c(ROH)<c(OH-) |
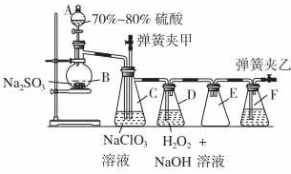 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.