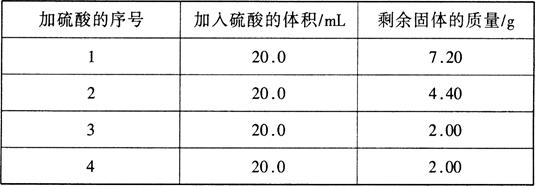
题目内容
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,17 g甲基(—14CH3)所含的中子数为9NA
②常温常压下,22.4 L NO气体的分子数小于NA
③56 g铁与16g硫充分反应,失去2NA个电子
④常温常压下,100 mL 0.5 mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况下,22.4 L二氯甲烷所含有的分子数为NA
⑥常温常压下,1 mol氦气含有的核外电子数为4NA
⑦1mol/LNaCl溶液表示1L水中含有NaCl 58.5g
⑧1molO2与足量金属钠反应,得到了4mol e?
⑨不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半
⑩1 mol Na2O2晶体中含有阴离子总数为NA
| A.①②⑧ | B.③④⑨ | C.②④⑩ | D.⑤⑥⑦ |
C
解析试题分析:甲基(—14CH3)的相对分子质量是17,所含中子数=14-6=8,所以常温常压下,17g甲基(—14CH3)所含的中子数为8NA,①不正确;常温常压下,气体的摩尔体积大于22.4L/mol,所以22.4 L NO气体的分子数小于NA,②正确;56g铁与16g硫的物质的量分别是1mol和0.5mol,二者充分反应生成FeS,铁过量,S不足,所以失去NA个电子,③不正确;常温常压下,100 mL 0.5 mol/L的乙酸溶液中溶质的物质的量是0.05mol,由于乙酸是弱电解质,存在电离平衡,所以溶液中乙酸的分子数目小于0.05NA,④正确;标准状况下,二氯甲烷不是气态,不能是由于气体摩尔体积,因此,22.4 L二氯甲烷的物质的量不是1mol,⑤不正确;He是单原子分子,常温常压下,1 mol氦气含有的核外电子数为2NA,⑥不正确;1mol/LNaCl溶液表示1L溶液中含有NaCl 58.5g,⑦不正确;1molO2与足量金属钠反应,生成物可能是氧化钠,也可能是过氧化钠,所以不能确定转移电子的物质的量,⑧不正确;硫酸的密度随溶液浓度的增大而增大,因此不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度不可能变为原来和的一半,⑨不正确;过氧化钠晶体中阴阳离子的个数之比是1:2,所以1mol Na2O2晶体中含有阴离子总数为NA,⑩正确,答案选C。
考点:考查阿伏加德罗常数的有关计算

下列说法正确的是
| A.标准状况下,22.4LCO2与22.4LH2SO4含有相同的分子数。 |
| B.标准状况下,1mol氧气和氮气的混和气体(任意比)的体积约为22.4L |
| C.常温下32gO2含分子数小于NA个。 |
| D.22.4L气体所含的分子数一定大于11.2L气体所含的分子数。 |
用NA表示阿伏伽德罗常数,下列说法正确的是
| A.反应KClO3+6HCl=KCl+3Cl2↑+ 3H2O中,每生成1molCl2转移的电子为2NA |
| B.1molC8H18分子中含有的共用电子对数为26NA |
| C.在0℃,101kPa,1molSO3中含有NA个硫原子 |
| D.0.5L0.1mol/LNH4Cl溶液中含NH4+离子的数目为0.05NA |
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X。则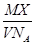 表示的是
表示的是
| A.VL该气体的质量(以g为单位) |
| B.1L该气体的质量(以g为单位) |
| C.1mol该气体的体积(以L为单位) |
| D.1L该气体中所含的分子数 |
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
| A.水的沸点;水分子的数目 | B.水的密度;水的摩尔质量 |
| C.水的体积;水中所含原子的数目 | D.水的质量;水的相对分子质量 |
在标况下,下列气体含有的分子数最多的是
| A.36.5g HCl | B.4 mol H2O | C.4g H2 | D.0.5mol SO2 |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
| A.若M(甲)>M(乙),则气体体积:甲<乙 |
| B.若M(甲)<M(乙),则气体的压强:甲>乙 |
| C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙 |
| D.若M(甲)<M(乙),则的分子数:甲<乙 |
下列叙述不正确的是
| A.与28 gCO具有相同分子数的C2H4的质量一定是28 g |
| B.1 molAl3+含有的核外电子数为3NA |
| C.常温常压下,1 molL甲烷含有的原子数为5NA |
| D.1 L 1 mol·L-1醋酸溶液中CH3COO+的数目小于NA |