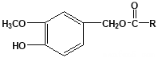
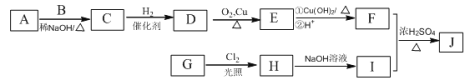
题目内容
【题目】当光束通过下列物质:①尘埃的空气 ②氢氧化钠溶液 ③蒸馏水 ④淀粉溶液,能观察到有丁达尔现象的是
A. ①② B. ②③ C. ①④ D. ②④
【答案】C
【解析】试题分析:①尘埃的空气、 ④淀粉溶液属于胶体,胶体能产生丁达尔效应,故C正确。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】下表为元素周期表的一部分:
碳 | 氮 | Y | |
X | 硫 | Z |
请回答下列问题:
(1)Z元素在周期表中的位置为________________。
(2)表中元素原子半径最大的是(写元素符号)________________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是________(填序号)。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)现有一定量的铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1 NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________________________,生成硫酸铜物质的量为_______________________。
【题目】(1) 把煤作为燃料可通过下列两种途径:
途径I:直接燃烧C(s)+O2(g)═CO2(g)(放热Q1kJ)
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)(吸热Q2kJ)
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)
2H2(g)+O2(g)═2H2O(g)(共放热Q3kJ)
试回答下列问题:
①判断两种途径放出热量大小:途径I ______(填“大于”、“等于”或“小于”)途径II
②Q 1、Q 2 、Q 3 的数学关系式是________________________。
③已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。
其他相关数据如下表:则表中x的值为_____________。
O===O | H—H | H—O(g) | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
④简述煤通过途径Ⅱ作为燃料的意义:______________________________

(2)化学反应可视为旧键断裂和新键形成的过程。如图为白磷(P4)和P4O6分子的分子结构示意图,其他相关数据如下表所示。则反应P4 +3O2 = P4O6的热量变化为:__________________。
O===O | P—P | P—O | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 198 | 360 |
(3)下列变化中属于放热反应的是______
A.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B.镁条与二氧化碳反应
C.干冰升华为气体
D.碳酸钙高温锻烧
【题目】下图是不完整的元素周期表。A~H八种元素的位置已确定,完成下列各题。
A | |||||||||||||||||
B | C | D | |||||||||||||||
E | F | G | |||||||||||||||
H | |||||||||||||||||
(1)用实线画出元素周期表的上边界。用阴影表示出非金属元素。(请用黑色水笔书写)__________
(2)用一个置换反应证明F和G的非金属性强弱:(书写离子方程式)_____________。
(3)已知A和C能形成含有18个电子的化合物,其含有的化学键的类型为__________、__________。
(4)已知A和C也能形成CA5的离子化合物,请书写其电子式__________________。
(5)H能与C的最高价氧化物对应的水化物的稀溶液反应,写出反应的离子方程式________________。
(6)判断B的氢化物和E的氢化物的沸点高低:BHm_____________EHm(填“大于”、“等于”或“小于”)。
(7)C的氢化物极易溶于D的氢化物的原因是_____________________________。
【题目】某化学兴趣小组为了探究碳酸钙与稀盐酸反应过程中的速率变化,在VmL稀盐酸中加入足量的碳酸钙,收集反应放出的CO2(气体体积已换算为标准状况下的数值),实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
CO2体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)0~1 min、1~2 min、2~3 min、3~4 min、4~5 min五个时间段中,_________反应速率最快。
(2)假设溶液体积不变,4~5min时间段以盐酸的浓度变化来表示的该反应速率为____________________________。
(3)为了降低上述化学反应的反应速率,向溶液中加入下列物质,你认为可行的是
_______________(填编号)。
a.蒸馏水 b.浓盐酸 c.NaCl固体 d.NaCl溶液
(4)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?(试写两条)_______________________________________________________________________,
________________________________________________________________________。