题目内容
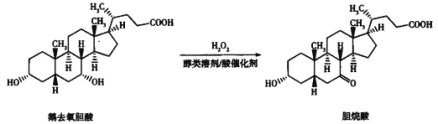
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
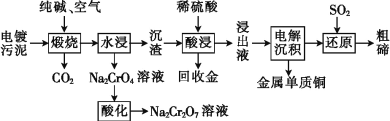
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为__________________。
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
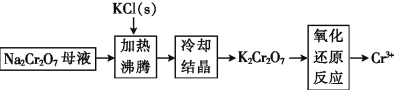
通过冷却结晶能析出大量K2Cr2O7的原因是__________________。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2![]() 被还原为Cr3+)
被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为________________。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。
(5)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31}
【答案】2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2 CuSO4(或CuSO4和H2SO4) 低温条件下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小 Cr2
4Na2CrO4+4CO2 CuSO4(或CuSO4和H2SO4) 低温条件下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小 Cr2![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O 49.0 是
2Cr3++6Fe3++7H2O 49.0 是
【解析】
(1)根据流程中“水浸”,Cr元素以Na2CrO4形式存在,Na2CrO4中Cr的化合价为+6价, Cr2O3中Cr的化合价为+3价,Cr2O3作还原剂,被氧气氧化,根据化合价升降法进行配平,“煅烧”时Cr2O3参加的反应是2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;
(2)“煅烧”除(1)中反应外,还有Cu2Te+2O2![]() 2CuO+TeO2,沉渣应含有CuO、TeO2以及少量的Au,加入稀硫酸,CuO与稀硫酸反应生成CuSO4,根据题干,Te以TiOsO4形式存在,Au不与稀硫酸反应,即浸出液中含有TeOsO4、CuSO4、H2SO4;
2CuO+TeO2,沉渣应含有CuO、TeO2以及少量的Au,加入稀硫酸,CuO与稀硫酸反应生成CuSO4,根据题干,Te以TiOsO4形式存在,Au不与稀硫酸反应,即浸出液中含有TeOsO4、CuSO4、H2SO4;
(3)Na2Cr2O7溶液加入KCl(s),得到K2Cr2O7,说明低温下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小;
(4)①Cr2O42-作氧化剂,把Fe2+氧化成Fe3+,+6价Cr被还原成Cr3+,根据得失电子数目守恒,得出Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②根据①的离子反应方程式得出:K2Cr2O7的纯度=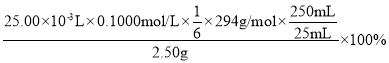 =49.0%;
=49.0%;
(5)Cr(OH)3开始出现沉淀时,溶液中c3(OH-)=![]() =2×10-26,Fe3+沉淀完全,c(Fe3+)应小于10-5mol·L-1,Fe(OH)3沉淀完全时,溶液中c3(OH-)=
=2×10-26,Fe3+沉淀完全,c(Fe3+)应小于10-5mol·L-1,Fe(OH)3沉淀完全时,溶液中c3(OH-)=![]() =4×10-33<2×10-26,说明Fe3+沉淀完全。
=4×10-33<2×10-26,说明Fe3+沉淀完全。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%