题目内容
(9分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白:
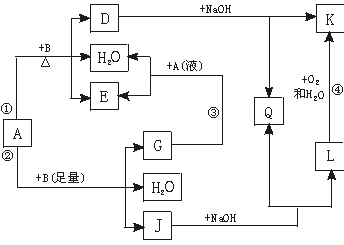
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):

(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
(1)白色沉淀 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?
(2)3Fe+2NO3-+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?(2)3Fe+2NO3-+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
试题分析:(1)A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B不加热可发生反应②,且②有3种产物,猜测A是硝酸,不是硫酸;硝酸具有强氧化性,与浓硝酸需加热才进行的B应是与浓硝酸发生钝化的金属铁或铝;由反应④可知B是变价金属铁;则J是硝酸亚铁,与氢氧化钠反应生成氢氧化亚铁和硝酸钠;所以反应④是氢氧化亚铁与氧气、水反应生成氢氧化铁的反应,现象是白色沉淀迅速转化为灰绿色,最终成为红褐色;
(2)反应②是稀硝酸与过量Fe反应生成硝酸亚铁、水、NO,离子方程式为3Fe+2NO3-+8H+="3" Fe 2++2NO↑+4 H2O;
(3)由流程图可知G是NO,与硝酸反应又生成NO2和水,所以浓硝酸与铁加热反应时,若生成NO立即又转化为NO2,所以实质是不可能生成NO。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
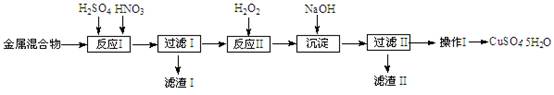
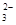 = 2Iˉ+S4O
= 2Iˉ+S4O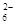
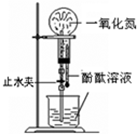

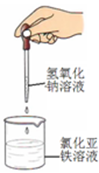
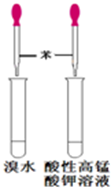
 图中单质可能为( )
图中单质可能为( )