题目内容
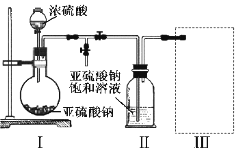
【题目】某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2![]() 2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。
2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。

请回答下列问题:
(1)装置①中浓硫酸的作用是________。
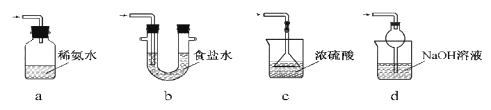
(2)若用装置②收集反应生成的气体,A应连接装置中的________(填“B”或“C”);
(3)收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈________色。
(4)实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为________mol/L(气体为标准状况下的体积)
【答案】干燥混合气体 B 红 ![]()
【解析】
(1)根据浓硫酸具有吸水性分析解答;
(2)反应生成的气体为NH3,NH3的密度比空气小,据此分析解答;
(3)NH3溶于水后形成氨水,溶液显碱性,据此分析解答;
(4)根据![]() 计算解答。
计算解答。
(1)浓硫酸具有吸水性,因此装置①中浓硫酸的作用是干燥混合气,故答案为:干燥混合气;
(2)反应生成的气体为NH3,NH3的密度比空气小,应该将空气从下口排出,用装置②收集NH3时,NH3应从长导管口进入,因此A应与装置②中的B相连,故答案为:B;
(3)NH3溶于水后形成氨水,氨水显碱性,酚酞遇碱变红色,因此溶液显红色,故答案为:红;
(4)设圆底烧瓶的容积为aL,则V(NH3)=aL,由于NH3极易溶于水,因此所得溶液的体积V=aL,在标准状态下,aLNH3的物质的量![]() =
=![]() , 所得溶液的物质的量浓度c=
, 所得溶液的物质的量浓度c=![]() =
=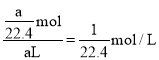 , 故答案为:
, 故答案为:![]() 。
。

练习册系列答案
相关题目