题目内容
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
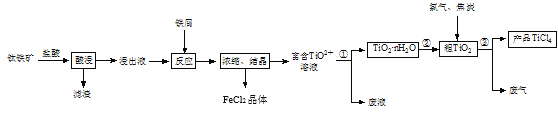
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
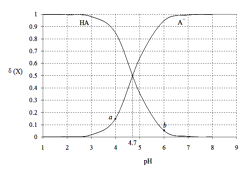
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
【答案】增大接触面积,加快反应速率 FeTiO3+4H+=TiO2++Fe2++2H2O 将Fe3+还原为Fe2+ 10-9~10-7m 用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净 TiO2+2C+2Cl2![]() TiCl4+2CO 过程③中产生的CO和残留的Cl2有毒,污染空气 蒸馏
TiCl4+2CO 过程③中产生的CO和残留的Cl2有毒,污染空气 蒸馏
【解析】
(1)将钛铁矿粉碎,可以增大固体反应物的接触面积,加快反应速率;
故答案为:增大接触面积,加快反应速率;
(2)根据已知信息,确定部分反应物FeTiO3和生成物TiO2+、Fe2+,再结合元素守恒,电荷守恒配平生成TiO2+的离子方程式为FeTiO3+4H+=TiO2++Fe2++2H2O;
故答案为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)根据题意:浸出液中含有少量Fe3+,而浸出液加入铁粉后浓缩、结晶得到FeCl2晶体,因此加入铁粉的目的是将Fe3+还原为Fe2+,加入铁屑至浸出液显紫色,说明Fe3+已完全被还原为Fe2+;
故答案为:将Fe3+还原为Fe2+;
(4)能够产生丁达尔效应的分散系为胶体,则分散质颗粒直径的范围是10-9~10-7m;
故答案为:10-9~10-7m;
(5)过量酸将Fe(OH)3中和为Fe3+,用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
故答案为:用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
(6)过程③反应物为TiO2、氯气、焦炭,生成的废气中含有CO,根据得失电子守恒、元素守恒写出方程式,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
故答案为:TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
(7)依据绿色化学理念,该工艺流程中存在的不足之处是过程③中产生的CO和残留的Cl2有毒,污染空气;
故答案为:过程③中产生的CO和残留的Cl2有毒,污染空气;
(8)SiCl4、TiCl4为液态混合物,沸点相差较大,因此可用蒸馏的方法提纯TiCl4;
故答案为:蒸馏。

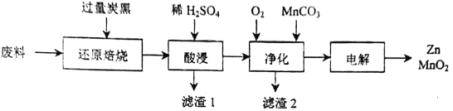
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
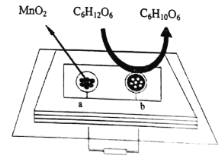
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
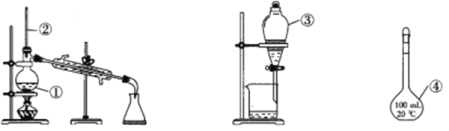
【题目】I.利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_______________________________________________________________
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。

①实验时所需要的玻璃仪器除烧杯、量筒外还需要:_________。
②该装置中有一处错误是:______________________,
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为______________________
(2)已知下列热化学方程式:
C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式____________________
(3)已知几种共价键的键能数据如下表:
共价键 | N≡N | H—H | N—H |
键能 (kJ/mol) | 946 | 436 | 390.8 |
写出合成氨反应的热化学方程式: ____________________________________。