题目内容
在Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,反应中,
(1)______元素被氧化,______是氧化剂.
(2)用双线桥标出该反应电子转移的方向和数目______.
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
(3)若有3.2g的Cu参与反应,则被还原的H2SO4的质量为多少?______.
| ||
(1)______元素被氧化,______是氧化剂.
(2)用双线桥标出该反应电子转移的方向和数目______.
Cu+2H2SO4(浓)
| ||
(3)若有3.2g的Cu参与反应,则被还原的H2SO4的质量为多少?______.
(1)S元素化合价降低,被还原,Cu元素化合价升高,被氧化,则浓H2SO4为氧化剂,Cu为还原剂,故答案为:Cu;浓H2SO4;
(2)S元素化合价降低,由+6价降低到+4价,Cu盐酸化合价由0价升高到+2价,反应中Cu失电子,S得电子,该反应电子转移的方向和数目可表示为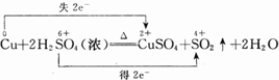 ,故答案为:
,故答案为: ;
;
(3)n(Cu)=
=0.05mol,1mol铜参加反应,则有1molH2SO4被氧化,则若有3.2g的Cu参与反应,被还原的硫酸的物质的量为0.05mol,
质量为0.05mol×98g/mol=4.9g,
故答案为:4.9g.
(2)S元素化合价降低,由+6价降低到+4价,Cu盐酸化合价由0价升高到+2价,反应中Cu失电子,S得电子,该反应电子转移的方向和数目可表示为
 ,故答案为:
,故答案为: ;
;(3)n(Cu)=
| 3.2g |
| 64g/mol |
质量为0.05mol×98g/mol=4.9g,
故答案为:4.9g.

练习册系列答案
相关题目