题目内容
15.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积.25℃时,在AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.已知有关物质的颜色和溶度积如下:| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 溶度积小的沉淀可以转化为溶度积更小的沉淀 | |
| B. | 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 | |
| C. | 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 | |
| D. | 25℃时,AgCl固体在等质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
分析 A.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀;
B.根据溶度积判断是否有沉淀生成;
C.根据溶度积计算Ag+的浓度;
D.溶度积只受温度的影响.
解答 解:A.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,如向AgCl的白色悬浊液中加入KI溶液,可生成AgI沉淀,故A正确;
B.Ag2S溶度积较小,加入Na2S溶液后,溶液中银离子浓度非常小,加入等浓度的KI溶液后,离子的浓度幂之积小于Ksp,不能生成黄色沉淀,故B正确;
C.饱和AgCl、AgI、Ag2S溶液中Ag+的浓度分别为:$\sqrt{1.8×1{0}^{-10}}$mol/L、$\sqrt{1.5×1{0}^{-16}}$mol/L、$\root{3}{\frac{1.8×1{0}^{-50}}{4}}$mol/L,Ag+的浓度不同,故C错误;
D.溶度积只受温度的影响,与溶液离子浓度的大小无关,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,注意把握溶度积常数的计算及应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.设NA 为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol羟基中电子数为10NA | |
| B. | 常温下,1L 0.1mol/L的NH4NO3的溶液中氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI=KI+3 I2+3 H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
6.下列化学方程式或离子方程式中正确的是( )
| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: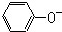 +CO2+H2O→ +CO2+H2O→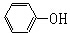 +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
10.下列选项的离子方程式所对应的化学反应正确的是( )
| 选项 | 离子方程式 | 所对应的化学反应 |
| A | HCO3-+OH-+Ca2+═CaCO3↓+H2O | 既可以表示少量NaHCO3与过量石灰水反应,也可以表示少量NaOH与过量Ca(HCO3)2反应 |
| B | H++OH-═H2O | 代表任何强酸与强碱反应 |
| C | Fe+2H+═Fe2++H2↑ | 代表铁与所有强酸反应 |
| D | Al3++4NH3•H2O═4NH4++AlO2-+2H2O | 代表可溶性铝盐与过量氨水反应 |
| A. | A | B. | B | C. | C | D. | D |
20.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢,已知部分物质20℃时的溶解度数据有:
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+H2O+CO2↑、MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度(g/100g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.0×10-1 | 26.7 |
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
7.下列几种微粒中能影响水的电离平衡,且能使水的电离平衡逆向移动的是( )
| A. | HSO4- | B. | Cl- | C. | 13X3+ | D. | 16X2- |
4.下列离子方程式中,不正确的是( )
| A. | KI的酸性溶液长期置于空气中:4I-+4H++O2═2I2+2H2O | |
| B. | 高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| C. | 用稀硫酸除去铁片表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O |
5.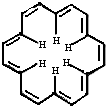 早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测在2003年被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图,有关它的说法正确的是( )
早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测在2003年被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图,有关它的说法正确的是( )
 早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测在2003年被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图,有关它的说法正确的是( )
早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测在2003年被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图,有关它的说法正确的是( )| A. | [18]-轮烯分子中所有原子不可能处于同一平面 | |
| B. | 1mol-[18]轮烯最多可与9mol氢气发生加成反应生成环烷烃 | |
| C. | [18]-轮烯的分子式为:C18H12 | |
| D. | [18]-轮烯与乙烯互为同系物 |
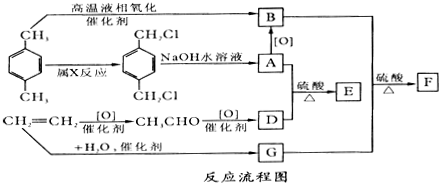
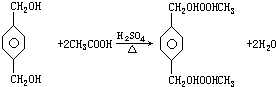 ;B+G→F
;B+G→F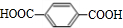 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$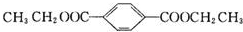 .
.