题目内容
常温下,分别取“银镜反应”(少许葡萄糖与过量银氨溶液作用)过滤后的剩余溶液,并向其中加入指定物质,反应后的溶液中主要存在的一组离子(有机物除外)正确的是
A. 通入过量的NH3(g): Ag+、NH4+、NO3-、OH-
B. 加入过量 HNO3(aq): NH4+、Ag+、H+、NO3-、
C. 通入过量 HCl(g): [Ag(NH3)2]+、NH4+、H+、Cl-、NO3-、
D. 加入过量NaOH(aq): [Ag(NH3)2]+、NH4+、Na+、NO3-、OH-
练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目


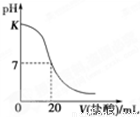
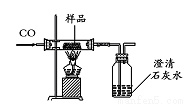
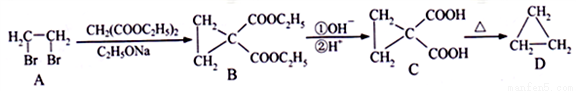
 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 的值减小
的值减小