题目内容
已知热化学方程式N2(g) + 3H2(g)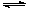 2NH3(g) + Q kJ(Q>0),下列说法中,正确的是
2NH3(g) + Q kJ(Q>0),下列说法中,正确的是
| A.1mol N2(g)和3mol H2(g)具有的能量之和低于2 mol NH3(g)具有的能量 |
| B.将1mol N2 (g)和3mol H2 (g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C.升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小 |
| D.将一定量N2(g)和H2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有3mol H2被氧化 |
D
解析试题分析:A、正方应是放热反应,则1mol N2(g)和3mol H2(g)具有的能量之和高于2 mol NH3(g)具有的能量,A不正确;B、反应是可逆反应,则将1mol N2 (g)和3mol H2 (g)置于一密闭容器中充分反应后放出的热量小于Q kJ,B不正确;C、反应热与平衡移动无关系,C不正确;D、根据热化学方程式可知每消耗3mol氢气放出QkJ热量,因此将一定量N2(g)和H2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有3mol H2被氧化,D正确,答案选D。
考点:考查反应热的有关判断与计算

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案某学生实验小组用50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定。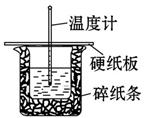
(1)图中装置缺少一种仪器,该仪器名称为______。
(2)下列说法正确的是______。
| A.小烧杯内残留有水,会使测得的反应热数值偏小 |
| B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 |
已知热化学方程式:SO2(g)+ 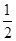 O2(g)
O2(g) 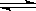 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
| A.196.64kJ | B.196.64kJ/mol | C.<196.64kJ | D.>196.64kJ |
以下反应属于吸热反应的是:
| A.锌与稀硫酸的反应 | B.氯化铵与氢氧化钡晶体反应 |
| C.煤的燃烧 | D.氢氧化钠与盐酸的反应 |
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) +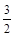 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) +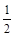 O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
| A.升高温度,可使①②反应速率均加快 |
| B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol |
| D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N?N为154,则断裂1molN?H键所需的能量(kJ)是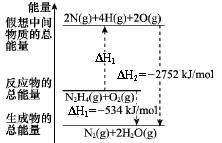
| A.194 | B.391 | C.516 | D.658 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知2Zn(s)+O2(g)=2ZnO(s)ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s)ΔH=-181.6 kJ·mol-1
2HgO(s)ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
| A.+519.4 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |