��Ŀ����
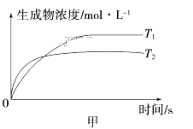
����Ŀ����1����ͼ��1mol NO2(g)��1mol CO(g)��Ӧ����CO2��NO�����е������仯ʾ��ͼ����֪E1��+134kJ��mol��1��E2��+368kJ��mol��1�����ڷ�Ӧ��ϵ�м����������Ӧ��������E1�ı仯��________(��������������С����������������ͬ)����H�ı仯��________����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��________��

��2����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO(NH2)2]����֪��
a��2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H����159.5kJ��mol��1
b��NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ��H��+116.5kJ��mol��1
c��H2O(l)=H2O(g) ��H��+44.0kJ��mol��1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ��________��
���𰸡���С ���� NO2(g)+CO(g)=NO(g)+CO2(g) ��H=-234kJ��mol��1 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H��-87kJ��mol��1
��������
��1����ͼ��֪�÷�ӦΪ���ȷ�Ӧ����Ӧ������������������������������H= E1-E2���ڷ�Ӧ��ϵ�м�����������Խ��ͷ�Ӧ�Ļ�ܣ������ı䷴Ӧ�ȣ�
��2�����ݸ�˹���ɽ��м��㲢��д�Ȼ�ѧ����ʽ��
��1����Ӧ��ϵ�м�����������Խ��ͷ�Ӧ�Ļ�ܣ������ı䷴Ӧ�ȣ����E1��С����H���䣻��H= E1-E2=134kJ��mol��1-368kJ��mol��1=-234 kJ��mol��1���Ȼ�ѧ����ʽΪ��NO2(g)+CO(g)=NO(g)+CO2(g) ��H=-234kJ��mol��1��
��2����Ӧa+b-c�ɵ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H��-87kJ��mol��1

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��![]() ʱ����
ʱ����![]() �����ܱ������г���
�����ܱ������г���![]() �ұ���������Ӧ��
�ұ���������Ӧ��
![]()
![]() ��
��
��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
ʱ�� | 0 | 10 | 20 | 30 | 40 |
|
|
|
|
|
|
|
|
|
|
|
|
����˵����ȷ����![]()
![]()
A.ǰ![]() ��
��![]()
B.�����������������䣬�����¶ȣ�ƽ��ʱ![]() �ұ�
�ұ�![]() ����
����![]()
C.���������������䣬�������г��벻���뷴Ӧ��ˮ������Ϊϡ�ͼ������ұ���ת����Ϊ![]()
D.��ͬ�¶��£���ʼʱ�������г���![]() �ұ���
�ұ���![]() ����ϩ��
����ϩ��![]() ���ﵽƽ��ǰ
���ﵽƽ��ǰ![]()