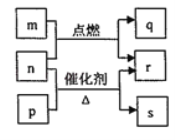
题目内容
【题目】某化学兴趣小组为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如下装置进行实验(夹持仪器已省略)。
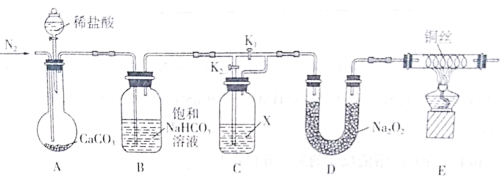
回答下列问题:
(1)实验开始前先通入一段时间的N2,目的是________。
(2)饱和NaHCO3溶液的作用是_________;试剂X是___________。
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,实验中观察到E中灼热的铜丝颜色未发生变化,则得出的结论是_______。
(4)若_____(填操作),E中灼热的铜丝变为黑色,可证明潮湿的CO2能与Na2O2反应。
(5)写出D中CO2与Na2O2反应的化学方程式___________。
【答案】排除装置中的空气 除去CO2气体中的HCl气体 浓硫酸 干燥的CO2不能与Na2O2反应 打开K1,关闭K2 2CO2+2Na2O2=2Na2CO3+O2
【解析】
为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如下装置进行实验,先用氮气排尽装置A中的空气,利用装置A制取CO2,通过装置B利用饱和碳酸氢钠溶液除去氯化氢气体,再通过装置C,装有浓硫酸,若打开K2关闭K1则为干燥的CO2,若打开K1关闭K2则为潮湿的CO2,经过装置D与过氧化钠作用,再通过装置E用灼热的铜丝检验是否有氧气生成,据此分析。
(1)后续实验要验证是否有氧气生成,故实验开始前先通入一段时间的N2,目的是排除装置中的空气;
(2)盐酸易挥发,制得的二氧化碳中含有氯化氢气体,饱和NaHCO3溶液的作用是除去CO2气体中的HCl气体;试剂X是起干燥剂作用,可选用浓硫酸;
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,则气体被干燥,为干燥的CO2,实验中观察到E中灼热的铜丝颜色未发生变化,则D中没有氧气生成,则得出的结论是干燥的CO2不能与Na2O2反应;
(4)若打开K1,关闭K2 ,则二氧化碳末被干燥,E中灼热的铜丝变为黑色,可证明潮湿的CO2能与Na2O2反应;
(5)D中CO2与Na2O2反应生成碳酸钠和氧气,反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2。

【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)![]() CH4(g)+C3H6(g),请回答下列问题:
CH4(g)+C3H6(g),请回答下列问题:
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25 ℃、101 kPa几种有机物的生成热如下表所示:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ· mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_____________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
下列情况能说明该反应达到平衡状态的是________(填标号)。
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率和乙烷消耗速率相等
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________。
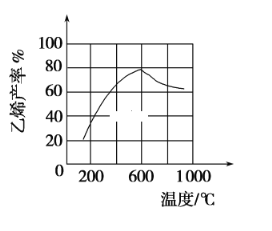
(4)在一定温度下向10 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)=________ mol·L-1·min-1。
②上述条件下,正丁烷的平衡转化率为_______,该反应的平衡常数K为_____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-===26CO32-,则负极反应式为_________________________。