题目内容
20.与Na+具有相同的质子数和电子数的微粒是( )| A. | CH4 | B. | H3O+ | C. | NH2- | D. | F- |
分析 Na+中质子数是11个,电子数是10个,依此进行判断.
解答 解:Na+中质子数是11个,电子数是10个.
A.CH4中质子数是10,电子数是10,所以和钠离子中质子数不同,电子数相同,故A错误;
B.H3O+质子数是11,电子数是10,所以和钠离子中质子数和电子数都相同,故B正确;
C.NH2-中质子数是9,电子数是10,所以和钠离子中质子数不同,电子数相同,故C错误;
D.F-中质子数是9,电子数是10,所以和钠离子中质子数不同,电子数相同,故D错误,
故选B.
点评 本题考查分子和离子中质子数和电子数的计算,难度不大.要注意阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.根据碱金属的性质变化规律可推测铯的性质,下列推测错误的是( )
| A. | 灼烧CsCl时,火焰有特殊的颜色 | |
| B. | CsNO3易溶于水 | |
| C. | 在钠、钾、铯三种单质中,钠的熔点最低 | |
| D. | CsOH是弱碱 |
14.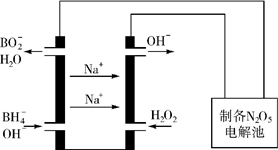 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”); 常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”); 常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
15.质量数为37的原子,应该有( )
| A. | 18个质子,19中子,19电子 | B. | 18个质子,20个中子,18个电子 | ||
| C. | 19个质子,18个中子,20个电子 | D. | 18个质子,19个中子,18个电子 |
12.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| B. | 用福尔马林保鲜鱼肉等食品对人体有害 | |
| C. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型不同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
10.坚决反对运动员服用兴奋剂,是“人文奥运”的一个基本原则.某一种兴奋剂的结构简式为有关该有机物的说法不正确的是( )


| A. | 它可使酸性高锰酸钾溶液褪色,也能使溴水褪色 | |
| B. | 它属于芳香烃 | |
| C. | 它与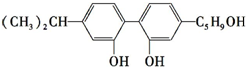 不是同分异构体 不是同分异构体 | |
| D. | 它既可发生加成反应,又可发生取代反应 |
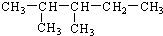 系统命名的名称为2,3-二甲基戊烷.
系统命名的名称为2,3-二甲基戊烷. .
. .
.
 ;
; (填结构简式).
(填结构简式).