题目内容
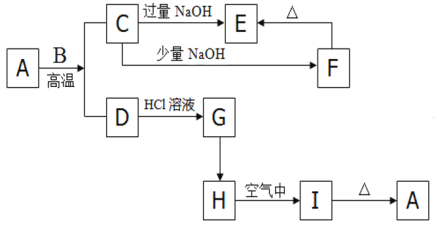
【题目】如下图的转化关系,A是一种红褐色的金属氧化物,B是一种非金属单质,H是一中难溶于水的白色化合物。
请回答下列问题:
(1)请写出下列物质的化学式:A________;F________;
(2)按要求写出下列离子方程式或化学方程式
A + B :_________________________________________________;
F → E:_____________________________________________________;
D → G:_____________________________________________(离子方程式);
(3)检验G中所含阳离子的方法是___________________________________________;
【答案】Fe2O3 NaHCO3 Fe2O3 + 3C == 2Fe + 3CO2↑ 2NaHCO3 = Na2CO3 + H2O + CO2↑ Fe + 2H+ = Fe2+ + H2↑ 加入KSCN无明显现象,再加入新制氯水,溶液变为血红色或加入NaOH,先产生白色沉淀,后变为灰绿色,最终变为红褐色
【解析】
A是一种红褐色的金属氧化物,所以A是Fe2O3,B是一种非金属单质,在高温下能和Fe2O3反应,说明B是碳;Fe2O3 + 3C ![]() 2 + 3CO2↑,则D为Fe,G为FeCl2, H是一中难溶于水的白色化合物,则H是Fe(OH)2,在空气中氧化为Fe(OH)3,则I为Fe(OH)3,加热2Fe(OH)3
2 + 3CO2↑,则D为Fe,G为FeCl2, H是一中难溶于水的白色化合物,则H是Fe(OH)2,在空气中氧化为Fe(OH)3,则I为Fe(OH)3,加热2Fe(OH)3![]() Fe2O3+3H2O;C为CO2,通人过量的NaOH溶液, CO2+2NaOH= Na2CO3 + H2O
Fe2O3+3H2O;C为CO2,通人过量的NaOH溶液, CO2+2NaOH= Na2CO3 + H2O
通人少量的NaOH溶液:H2O+ CO2+NaOH= NaHCO3 ,则E 为Na2CO3、F为NaHCO3。
(1)综合上述分析物质A的化学式:Fe2O3,物质F的化学式NaHCO3;答案:Fe2O3,NaHCO3。
(2)下列离子方程式或化学方程式:A + B : Fe2O3 + 3C ![]() 2 + 3CO2↑;
2 + 3CO2↑;
F → E:2NaHCO3 = Na2CO3 + H2O + CO2↑ D → G:Fe + 2H+ = Fe2+ + H2↑;
(3)G为FeCl2,检验G中所含Fe2+阳离子为的方法;加入KSCN无明显现象,再加入新制氯水,溶液变为血红色或加入NaOH,先产生白色沉淀,后变为灰绿色,最终变为红褐色
。

【题目】在三个容积均为1L的恒温恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应3CO(g)+3H2(g)![]() (CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
(CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
容器 | 起始物质的量/mol | 平衡 转化率 | |||
CO | H2 | (CH3)2O | CO2 | CO | |
Ⅰ | 0.3 | 0.3 | 0 | 0 | 50% |
Ⅱ | 0.3 | 0.3 | 0 | 0.1 | |
Ⅲ | 0 | 0 | 0.2 | 0.4 | |

下列说法正确的是( )
A. 该反应的△H<0,图中压强p1>p2
B. 达到平衡时,容器Ⅱ中CO的平衡转化率大于50%
C. 达到平衡时,容器Ⅰ与容器Ⅱ的总压强之比小于4∶5
D. 达到平衡时,容器Ⅲ中n[(CH3)2O]是容器Ⅱ中的2倍