题目内容
(2011?石家庄二模)如图所示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb.
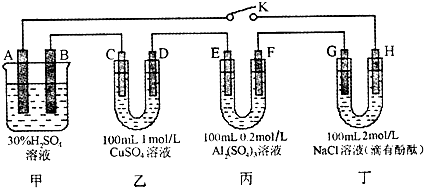
闭合K,发现G电极附近的溶液变红,20min后,将K断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是
(3)到20min时,电路中通过电子的物质的量为
(4)0~20min,H电极上发生反应的电极反应式为:
(5)20min后将乙装置与其他装置断开,然后在C、D两极间连上灵敏电流计,发现电流计指针偏转,则此时C电极为
| 放电 | 充电 |

闭合K,发现G电极附近的溶液变红,20min后,将K断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是
PbO2
PbO2
(填“PbO2”或“Pb”).(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是
H2O
H2O
(填化学式).(3)到20min时,电路中通过电子的物质的量为
0.4mol
0.4mol
.(4)0~20min,H电极上发生反应的电极反应式为:
2Cl--2e-=Cl2↑;2H++2e-=H2↑
2Cl--2e-=Cl2↑;2H++2e-=H2↑
.(5)20min后将乙装置与其他装置断开,然后在C、D两极间连上灵敏电流计,发现电流计指针偏转,则此时C电极为
负极
负极
极,D电极上发生的电极反应式为:2H++2e-=H2↑
2H++2e-=H2↑
.分析:甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现G电极附近的溶液变红,说明G电极是电解池的阴极,H是电解池的阳极;所以A为正极,B为负极;C电极为阴极,D为阳极;E电极为阴极,F为阳极;20min后,将K断开,此时C、D两极上产生的气体体积相同,
C电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑
D电极上发生的电极反应为:4OH--4e-=2H2O+O2↑
(1)依据分析判断电极名称;
(2)电解过程是电解水,要使丙硫酸铝溶液恢复到原来的浓度,需加入的物质是水;
(3)到20min时,电路中通过电子的物质的量可以依据电极反应中电子守恒计算得到;
(4)0~20min,H电极上发生反应的电极反应式为H是电解池的阳极,依据电子守恒先反应的是:2Cl--2e-=Cl2↑Cl-物质的量为0.2mol,和电子转移总数比较判断离子放电的反应;
(5)20min后将乙装置与其他装置断开,然后在C、D两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,电解时C电极上析出铜,断开连接形成原电池的负极,正极上是氢离子得到电子生成氢气;
| 放电 |
| 充电 |
C电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑
D电极上发生的电极反应为:4OH--4e-=2H2O+O2↑
(1)依据分析判断电极名称;
(2)电解过程是电解水,要使丙硫酸铝溶液恢复到原来的浓度,需加入的物质是水;
(3)到20min时,电路中通过电子的物质的量可以依据电极反应中电子守恒计算得到;
(4)0~20min,H电极上发生反应的电极反应式为H是电解池的阳极,依据电子守恒先反应的是:2Cl--2e-=Cl2↑Cl-物质的量为0.2mol,和电子转移总数比较判断离子放电的反应;
(5)20min后将乙装置与其他装置断开,然后在C、D两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,电解时C电极上析出铜,断开连接形成原电池的负极,正极上是氢离子得到电子生成氢气;
解答:解:依据题干信息和图示可知,甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现G电极附近的溶液变红,说明G电极是电解池的阴极,H是电解池的阳极;所以A为正极,B为负极;C电极为阴极,D为阳极;E电极为阴极,F为阳极;20min后,将K断开,此时C、D两极上产生的气体体积相同,
C电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑
D电极上发生的电极反应为:4OH--4e-=2H2O+O2↑
(1)A电极是铅蓄电池的正极,正极的电极材料是PbO2;故答案为:PbO2;
(2)电解过程是电解水,要使丙硫酸铝溶液恢复到原来的浓度,需加入的物质是水;故打为:H2O;
(3)20min后,将K断开,此时C、D两极上产生的气体体积相同,溶液中铜离子物质的量为0.1mol,设生成氢气物质的量为x,则氧气物质的量为x,结合电极上电子守恒计算得到:
C电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑
D电极上发生的电极反应为:4OH--4e-=2H2O+O2↑
4x=2x+0.1×2
x=0.1mol,所以电路中电子转移总数为0.4mol,故答案为:0.4mol;
(4)0~20min,H电极上发生反应的电极反应式为H是电解池的阳极,依据电子守恒先反应的是:2Cl--2e-=Cl2↑Cl-物质的量为0.2mol,转移电子物质的量为0.2mol,溶液中电子转移总数为0.4mol,所以溶液中氢离子继续放电,电极反应为2H++2e-=H2↑;故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
(5)20min后将乙装置与其他装置断开,然后在C、D两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,电解时C电极上析出铜,断开连接形成原电池的负极,正极上是氢离子得到电子生成氢气;电极反应为:2H++2e-=H2↑;故答案为:负极;2H++2e-=H2↑.
| 放电 |
| 充电 |
C电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑
D电极上发生的电极反应为:4OH--4e-=2H2O+O2↑
(1)A电极是铅蓄电池的正极,正极的电极材料是PbO2;故答案为:PbO2;
(2)电解过程是电解水,要使丙硫酸铝溶液恢复到原来的浓度,需加入的物质是水;故打为:H2O;
(3)20min后,将K断开,此时C、D两极上产生的气体体积相同,溶液中铜离子物质的量为0.1mol,设生成氢气物质的量为x,则氧气物质的量为x,结合电极上电子守恒计算得到:
C电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑
D电极上发生的电极反应为:4OH--4e-=2H2O+O2↑
4x=2x+0.1×2
x=0.1mol,所以电路中电子转移总数为0.4mol,故答案为:0.4mol;
(4)0~20min,H电极上发生反应的电极反应式为H是电解池的阳极,依据电子守恒先反应的是:2Cl--2e-=Cl2↑Cl-物质的量为0.2mol,转移电子物质的量为0.2mol,溶液中电子转移总数为0.4mol,所以溶液中氢离子继续放电,电极反应为2H++2e-=H2↑;故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
(5)20min后将乙装置与其他装置断开,然后在C、D两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,电解时C电极上析出铜,断开连接形成原电池的负极,正极上是氢离子得到电子生成氢气;电极反应为:2H++2e-=H2↑;故答案为:负极;2H++2e-=H2↑.
点评:本题考查了原电池电解池的原理应用,电池判断的方法,电极名称判断,电极产物的分析计算,主要是电极反应中 存在电子守恒的应用.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
