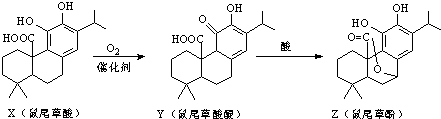
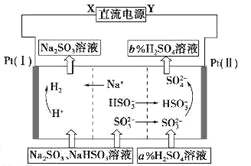
题目内容
【题目】莫尔盐[(NH4)2SO4FeSO46H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取莫尔盐,实验步骤如下: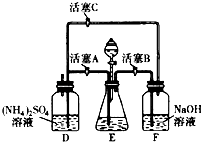
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离,将分离出的NaOH溶液装入F中;
②在E中用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合,结晶得到莫尔盐.
试回答下列问题:
(1)利用铁屑和稀硫酸反应产生的氢气赶走装置中的氧气及硫酸铵溶液中溶解的氧,其目的是;铁屑和稀硫酸反应产生的氢气的另外一个作用是 .
(2)设计一个简单的实验证明产品中有Fe2+ .
(3)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10mL用0.10molL﹣1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.①试配平反应的离子方程式:
②试求产品中莫尔盐的质量分数(NH4)2SO4FeSO46H2O的相对分子质量为392).
【答案】
(1)防止亚铁盐被氧化;将FeSO4溶液压至(NH4)2SO4溶液中
(2)将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水后变成血红色
(3)MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O;80.00%
【解析】解:(1)由装置图可知,向容器F中通入氢气,应关闭活塞A,打开活塞B、C.硫酸铵溶液中的溶解O2 , 容器D液面上部有O2 , Fe2+易被氧化为Fe3+ , 通入氢气赶走硫酸铵溶液中的溶解O2和容器D液面上部的O2 , 防止Fe2+被氧化为Fe3+;F中的NaOH溶液的主要作用是除去混在氢气中的酸性气体;当关闭活塞B、C,打开A时,E中随着氢气的量的增大,气压增大,E中的液体被压入D中,即将FeSO4溶液压至(NH4)2SO4溶液中,所以答案是:防止亚铁盐被氧化;将FeSO4溶液压至(NH4)2SO4溶液中;(2)将少许所得晶体放入KSCN溶液不变色,说明没有Fe3+ , 再向溶液中加入氯水后变成血红色,则含有Fe2+ , 所以答案是:将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水后变成血红色;(3)①高锰酸钾与Fe2+的反应是MnO4﹣~Mn2+~5e﹣;Fe2+~Fe3+~e﹣;依据电子守恒,铁离子和亚铁离子前乘5,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O;所以答案是:1、5、8、1、5、4; ②假设24.50g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4﹣ ,
5 1
xmol 0.01L×0.1000mol/L×10
所以x= ![]() =0.05mol.
=0.05mol.
所以24.50g产品中(NH4)2SO4FeSO46H2O的为0.05mol,所以24.50g产品中(NH4)2SO4FeSO46H2O的质量为0.05mol×392g/mol=19.6g.所以24.50g产品中(NH4)2SO4FeSO46H2O的质量分数为 ![]() ×100%=80%.所以答案是:80%.
×100%=80%.所以答案是:80%.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案