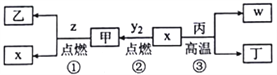
��Ŀ����
����Ŀ��ˮ�����ӻ�����Kw���¶�T(��)�йأ�
��1����T=25��ʱ,Kw=____________����T=100��ʱ��Kw=1��10-12������¶���0.05mol/LBa(OH)2 ��Һ��pH=____________.
��2����֪25��ʱ��0.1L 0.1molL-1��NaA��Һ��pH=10�������ӷ���ʽ��ʾ��ԭ��Ϊ______________��
��3��25��ʱ����pH=11��NaOH��Һ��pH=4��������Һ��ϣ������û����ҺpH=9����NaOH��Һ��������Һ�������Ϊ_____________����Ϻ������仯���Բ��ƣ���
���𰸡� 1��10��14 11 A����H2O![]() HA��OH�� 1:9
HA��OH�� 1:9
����������1����T=25��ʱ,ˮ�����ӻ�����Kw=1��10��14 ��0.05mol/LBa(OH)2 ��Һ��c(OH-)=0.1mol/L,c(H+)= Kw/ c(OH-)=1��10-12/0.1=10-11, pH=11����ȷ�𰸣�1��10��14 ��11��
��2��NaA��Һ��pH=10��ˮ���Լ��ԣ�˵������Ϊǿ�������Σ�. A������ˮ�⣺A����H2O![]() HA��OH������ȷ�𰸣�A����H2O
HA��OH������ȷ�𰸣�A����H2O![]() HA��OH����
HA��OH����
��3����NaOH��Һ�����Ϊx L , ������Һ�����Ϊy L��pH=11��NaOH��Һc(H+)=10-11 mol/L��c(OH-)=10-3 mol/L��pH=4��������Һc(H+)=10-4mol/L����Ӧ����Һ�Լ���pH=9��c(H+)��=10-9mol/L��c(OH-)��=10-5 mol/L��������㹫ʽ����c(OH-)��x- c(H+)��y��/��x+y��= c(OH-)�죻��10-3��x-10-4��y��/��x+y��=10-5,��֮���Ϊx��y=1:9����ȷ�𰸣�1:9��