题目内容
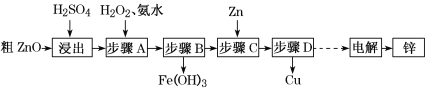
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
【答案】将粗氧化锌粉碎成细颗粒、适当增加硫酸的浓度、适当升高温度(任写一点)3.2≤pH<5.22Fe2++H2O2+2H+===2Fe3++2H2O过滤ZnO+2NaOH+H2O===Na2[Zn(OH)4] [Zn(OH)4]2-+2e-===Zn+4OH-
【解析】
(1)根据影响化学反应速率的因素,酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有将粗氧化锌粉碎成细颗粒、适当增加硫酸的浓度、适当升高温度等,故答案为:将粗氧化锌粉碎成细颗粒(或适当增加硫酸的浓度、适当升高温度等);
(2)氢氧化铁沉淀时的pH是1.48~3.2,Zn(OH)2沉淀时的pH为6.2~8.0;和Cu(OH)2沉淀时的pH为5.2~6.4,因此将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围为3.2≤pH<5.2,加入H2O2,发生过氧化氢氧化亚铁离子的反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:3.2≤pH<5.2;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)步骤C中加入锌,发生锌和硫酸铜反应生成铜和硫酸锌,从混合物中分离得到铜的方法为过滤,故答案为:过滤;
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为ZnO+2NaOH+H2O=Na2[Zn(OH)4];然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为[Zn(OH)4]2-+2e-=Zn+4OH-,故答案为:ZnO+2NaOH+H2O=Na2[Zn(OH)4];[Zn(OH)4]2-+2e-=Zn+4OH-。

【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
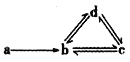
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④