题目内容
【题目】填空题
(1)“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO.
①Ca元素原子结构示意图________,Ca(OH)2碱性比Mg(OH)2______(填“强”或“弱”).
②配平用“金属钙线”脱氧脱磷的方程式:___P +____FeO +____CaO![]() ____Ca3(PO4)2 +____Fe
____Ca3(PO4)2 +____Fe
③将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:_____________________,实验室检测Mn+最常用的试剂是___________(填化学式)
④取3.2 g“金属钙线”试样,与水充分反应,生成448 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3________g,“金属钙线”试样中金属M的质量分数为______.
(2)氢化钙(CaH2)固体登山运动员常用的能源提供剂
①写出CaH2与水反应的化学方程式__________________,该反应的氧化产物是___.
②请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_____.
③登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________________.
【答案】 强 2 5 3 1 5 4Fe(OH)2+O2+2H2O=4Fe(OH)3 KSCN 2.2 71.5% CaH2+2H2O=Ca(OH)2+2H2↑ H2 取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色(或其它合理的答案) 氢化钙是固体,携带方便
强 2 5 3 1 5 4Fe(OH)2+O2+2H2O=4Fe(OH)3 KSCN 2.2 71.5% CaH2+2H2O=Ca(OH)2+2H2↑ H2 取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色(或其它合理的答案) 氢化钙是固体,携带方便
【解析】
(1)①根据原子核外电子排布画出原子结构示意图;元素的金属性越强最高价氧化物对应的水化物的碱性越强;
②根据电子守恒和原子守恒配平化学方程式;
③红褐色沉淀为Fe(OH)3,再写出发生反应的化学方程式和利用Fe3+的特殊反应检验;
④钙与水反应生成氢氧化钙与氢气,根据n=![]() 计算氢气的物质的量,根据电子转移守恒计算Ca的物质的量,根据氧化钙的质量分数计算氧化钙的质量,计算氧化钙的物质的量,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根据m=nM计算碳酸钙的质量;
计算氢气的物质的量,根据电子转移守恒计算Ca的物质的量,根据氧化钙的质量分数计算氧化钙的质量,计算氧化钙的物质的量,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根据m=nM计算碳酸钙的质量;
(2)①CaH2中H元素的化合价为-1价,CaH2具有还原性,与水发生氧化还原反应生成Ca(OH)2和H2;;
②区分钙和氢化钙时可利用其组成、性质的差异来判断;
③氢化钙是固体,易携带。
(1)①Ca是20号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,8,2,所以其原子结构示意图为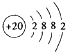 ,元素的金属性越强最高价氧化物对应的水化物的碱性越强,金属性Ca>Mg,所以Ca(OH)2的碱性比Mg(OH)2 强;
,元素的金属性越强最高价氧化物对应的水化物的碱性越强,金属性Ca>Mg,所以Ca(OH)2的碱性比Mg(OH)2 强;
②该方程式中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2 P+5FeO+3CaO![]() Ca3(PO4)2+5Fe;
Ca3(PO4)2+5Fe;
③说明是FeCl2溶液中滴加NaOH溶液,先生成白色Fe(OH)2沉淀,再在空气中氧化为Fe(OH)3,该颜色变化过程的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe 3+ 的检验方法是:向溶液中加入KSCN溶液后,溶液变成血红色就说明原溶液有Fe 3+;
④448mlH2的物质的量为![]() =0.02mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为
=0.02mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为![]() =0.02mol,样品中CaO质量分数为3.5%,故氧化钙的质量为3.2g×3.5%=0.112g,故氧化钙的物质的量为
=0.02mol,样品中CaO质量分数为3.5%,故氧化钙的质量为3.2g×3.5%=0.112g,故氧化钙的物质的量为![]() =0.002mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.02mol+0.002mol=0.022mol,碳酸钙的质量为0.022mol×100g/mol=2.2g;“金属钙线”试样中金属Fe的质量分数为
=0.002mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.02mol+0.002mol=0.022mol,碳酸钙的质量为0.022mol×100g/mol=2.2g;“金属钙线”试样中金属Fe的质量分数为![]() =71.5%;
=71.5%;
(2)①CaH2和水反应都能产生Ca(OH)2和H2,反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,反应中CaH中H元素从-1价升高为0价,则该反应的氧化产物是H2;
②CaH2可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色,具体方法是:取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色;
③作为能源,氢化钙明显比氢气更易携带,使用也较方便。

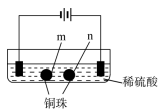
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜