题目内容
【题目】
H、C、N、O、W、Fe、V都是生活与化学工业中常见元素,请回答下列问题:
⑴碳负离子CH3-的空间构型为_______;根据等电子原理,NO+的电子式为________。
⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是________;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为______。

(3)钒可用于人工合成的二价钒固氮美酶(结构如图甲)。钒固氮酶中钒的配位原子有__________(填元素符号)。
(4)烟酰胺(结构如图乙)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有______,1 mol该分子中含σ键的数目为________________。
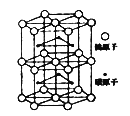
(5)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有______个,假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________。
(6)12 g石墨烯(结构如图丙)中含有的正六边形的物质的量为_____mol;请你预测硅是否容易形成类似石墨烯的结构,并说明理由____________________。
【答案】 三角锥形 [![]() ]+ Fe3+ [Cu(H2O)4]2+ N、S sp3,sp2 15NA 6 6
]+ Fe3+ [Cu(H2O)4]2+ N、S sp3,sp2 15NA 6 6 ![]() 0.5 不容易,硅原子半径大于碳原子半径,且3p轨道不易重叠形成键
0.5 不容易,硅原子半径大于碳原子半径,且3p轨道不易重叠形成键
【解析】(1)碳负离子CH3-中碳原子的价层电子对数=3+(4+1-3×1)/2=4,含有一对孤对电子,所以空间构型为三角锥形;NO+与氮气互为等电子体,则根据等电子原理,NO+的电子式为![]() 。⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,所以未成对电子数最多的是Fe3+;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+。(3)由图可知,钒固氨酶中钒的配位原子有S与N;(4)由烟酰胺结构式可知,分子中氨基中N原子成3个σ键、含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,而环中N原子成2个σ键、含有1对孤电子对,杂化轨道数目为3,采取sp2杂化;分子中含有4个C-H键、2个N-H键、3个C-C键、,2个C-N键、4个双键,单键为σ键,双键含有1个σ键、1个π键,故分子中含有σ键为15,故lmol该分子中含σ键数目为15NA;(5)在此结构中钨原子数目为1+2×1/2+12×1/6+6×1/3=6,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个;结构中W原子数目为6、C原子数目为6,则晶胞的质量为
。⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,所以未成对电子数最多的是Fe3+;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+。(3)由图可知,钒固氨酶中钒的配位原子有S与N;(4)由烟酰胺结构式可知,分子中氨基中N原子成3个σ键、含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,而环中N原子成2个σ键、含有1对孤电子对,杂化轨道数目为3,采取sp2杂化;分子中含有4个C-H键、2个N-H键、3个C-C键、,2个C-N键、4个双键,单键为σ键,双键含有1个σ键、1个π键,故分子中含有σ键为15,故lmol该分子中含σ键数目为15NA;(5)在此结构中钨原子数目为1+2×1/2+12×1/6+6×1/3=6,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个;结构中W原子数目为6、C原子数目为6,则晶胞的质量为![]() ,则
,则![]() =Vcm3×b g/cm3,故NA=6M/bV;(6) 12g石墨烯中碳原子的物质的量为12g÷12g/mol=1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形含有6×1/3=2,则含有的正六边形数目为1mol×1/2×NAmol-1=0.5NA,物质的量是0.5mol;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,因此硅不容易形成类似石墨烯的结构。
=Vcm3×b g/cm3,故NA=6M/bV;(6) 12g石墨烯中碳原子的物质的量为12g÷12g/mol=1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形含有6×1/3=2,则含有的正六边形数目为1mol×1/2×NAmol-1=0.5NA,物质的量是0.5mol;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,因此硅不容易形成类似石墨烯的结构。

 阅读快车系列答案
阅读快车系列答案


